
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期元素原子半径 Cl<S<Na | B、在卤化氢中HF最不稳定 | C、在钠、钾、铷三种单质中,钠的熔点最高 | D、主族元素的最高正化合价一般等于其最外层电子数 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省河西五市高三第一次联合考试化学试卷(解析版) 题型:填空题
已知:A、B、C、D四种短周期元素,其化合价最高正价数依次为1、4、5、7,已知B原子的核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的酸。试回答下列有关的问题:
(1)写出C元素原子的价电子轨道表达式 ;D元素的价电子排布式 。
(2)已知B元素与氢元素形成的气态化合物在标准状况下的密度为1.161g·L-1,则在该化合物的分子中B原子的杂化方式为 。
(3)已知C、D两种元素形成的化合物通常有CD3、CD5两种。这两种化合物中一种为非极性分子,一种为极性分子,则属于极性分子的化合物的化学式是 。
(4)由B元素形成具有正四面体结构的晶体和由C元素形成具有正四面体结构的晶体相比,熔点较高的晶体是 (填写晶体的名称)。
(5)由A、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为A、D形成化合物的晶胞结构图以及晶胞的剖面图:
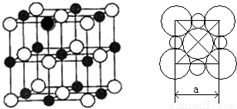 若
若
a=5.6×10-8cm,则该晶体的密度为 g·cm-3(精确到小数点后1位)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第一次月考化学试卷(解析版) 题型:填空题
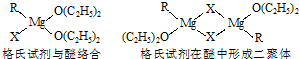
(10分)(1)金属镁有许多重要的用途,法国化学家维多克·格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:


①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出。
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为______ ;Mg 原子的核外电子排布式可表示为______________________。
③下列比较中正确的是____________
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:
TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
①Ti元素在元素周期表中的位置是 , 钛原子的外围电子排布式为 。
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于 (填“原子”、“分子”或“离子”)晶体。
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水,下列说法正确的是 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
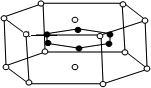
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。下图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,在棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为 。(填字母选项)

A.MgB B.MgB2 C.Mg2B D.Mg3B2
查看答案和解析>>
科目:高中化学 来源:高考真题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com