
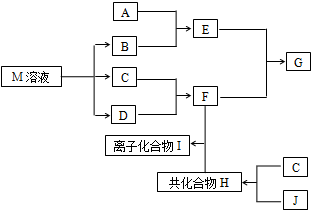
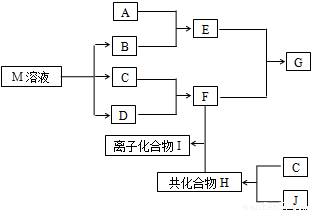
 短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则:
短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则: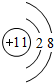 ,氮气分子的电子式为
,氮气分子的电子式为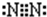 ,故答案为:
,故答案为: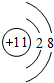 ;
;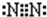 ;
;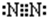 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
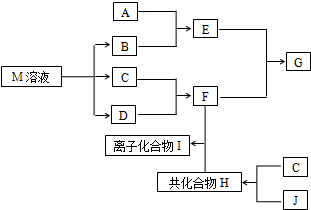 短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则:
短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则:



查看答案和解析>>
科目:高中化学 来源: 题型:
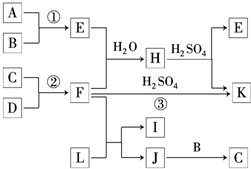 如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).已知:
如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).已知:查看答案和解析>>
科目:高中化学 来源: 题型:
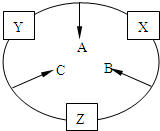 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子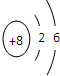
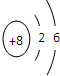
| ||
| △ |
| ||
| △ |
 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2009年安徽省高考化学模拟试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com