
���� ��1����ʱ��c��A��=$\frac{1.0mol}{2L}$=0.5mol/L��c��B��=$\frac{0.4mol}{2L}$=0.2mol/L��c��C��=$\frac{0.4mol}{2L}$=0.2mol/L��
��ѧƽ�ⳣ��K=$\frac{{c}^{2}��C��}{c��A����{c}^{3}��B��}$��
��2�����º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L����Ũ�����뻯ѧƽ�ⳣ����Դ�С�ж�ƽ���ƶ�����
��� �⣺��1����ʱ��c��A��=$\frac{1.0mol}{2L}$=0.5mol/L��c��B��=$\frac{0.4mol}{2L}$=0.2mol/L��c��C��=$\frac{0.4mol}{2L}$=0.2mol/L��
��ѧƽ�ⳣ��K=$\frac{{c}^{2}��C��}{c��A����{c}^{3}��B��}$=$\frac{��0��{2��}^{2}}{0.5����0.2��^{3}}$=10��
�ʴ�Ϊ��10��
��2�����º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L��Ũ����=$\frac{��\frac{1}{6}��^{2}}{\frac{17}{30}����\frac{1}{6}��^{3}}$=10.9��K��ƽ�������ƶ���
�ʴ�Ϊ�������º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L��Ũ����=$\frac{��\frac{1}{6}��^{2}}{\frac{17}{30}����\frac{1}{6}��^{3}}$=10.9��K��ƽ�������ƶ���
���� ���⿼�黯ѧƽ����㣬Ϊ��Ƶ���㣬���ؿ���ѧ�������������������á�����ʽ����������⣬ע�⣨2����Ҫ����Ũ�����뻯ѧƽ�ⳣ����Դ�С�ж�ƽ���ƶ����ܶ�ͬѧ�������ԡ���������ı䡱����ΪAŨ������ƽ�������ƶ���Ϊ�״��㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڳ����µ����������������ȶ� | |
| B�� | ���������ȵĵ��ʳ�����Ϊ���� | |
| C�� | ���������ȷ����ڷ�Ӧ�������ͷ����� | |
| D�� | �������������������ܶȲ�ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢ� | B�� | �٢ڢۢ� | C�� | �ۢܢݢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1 mol CO�� 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| ƽ�� ʱ�� �� | ��Ӧ�����仯�ľ���ֵ��kJ�� | a | b | c |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̿ȼ������һ����̼ | B�� | Ba��OH��2•8H2O��NH4Cl��Ӧ | ||
| C�� | п����ϡ���ᷴӦ��ȡH2 | D�� | �кͷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
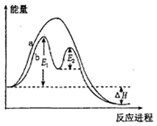
| A�� | ��Ӧ����a�д������� | |
| B�� | �÷�ӦΪ���ȷ�Ӧ | |
| C�� | �ı�������ɸı�÷�Ӧ�Ļ�� | |
| D�� | �д��������£���Ӧ�Ļ�ܵ���E1+E2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com