
【题目】兔耳草醛H是一种重要的香料,主要用于食品、化妆品等工业中。用有机物A为原料可以合成兔耳草醛H,其合成路线如图所示,其中有机物A的核磁共振氢谱只有一组峰:

中间产物D是一种精细化工产品,可用作香料,能发生如下反应:

已知:I.醛与二元醇(如乙二醇)可发生以下反应: ![]()
Ⅱ. ![]()
请回答:
(1)D的结构简式为________,E中含有的官能团名称为_________。
(2)A与反应物a在AlCl3催化下得到B,该反应源于工业制乙苯,则反应物a为__________(写出结构简式),该反应的反应类型为________________________
(3)由C到D需要两步反应,请依次写出反应条件_____________________________
(4)F→G的反应类型___________, G→H的化学方程式为____________________________。
(5)兔耳草醛H中的含氧官能团易被氧化,生成化合物W,G与W可发生酯化反应,写出G与W反应的化学方程式_____________________________________________。
(6)写出与W互为同分异构体且符合下列条件所有同分异构体的结构简式________
a.属于芳香族化合物且苯环上有三个取代基
b.1 mol该物质最多可消耗2molNaOH
c.能发生银镜反应
d.核磁共振氢谱有5组峰(面积为12:2:1:2:1)
【答案】 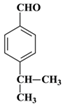 羟基、醛基
羟基、醛基 ![]() 加成反应 NaOH水溶液/加热 O2/Cu 加热 加成反应(还原反应)
加成反应 NaOH水溶液/加热 O2/Cu 加热 加成反应(还原反应) 
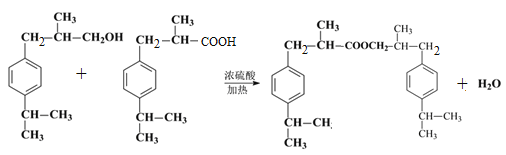
【解析】有机物A的核磁共振氢谱只有一组峰,根据C的结构简式可知A应该是苯。根据C的结构简式可知B的结构简式为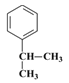 ,A与a反应生成B,所以a是丙烯,与苯发生加成反应生成B。根据D与聚乙烯醇反应的生成物结构简式结合已知信息I可判断D的结构简式为
,A与a反应生成B,所以a是丙烯,与苯发生加成反应生成B。根据D与聚乙烯醇反应的生成物结构简式结合已知信息I可判断D的结构简式为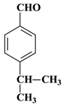 ,即C首先发生水解反应氯原子被羟基代替,然后羟基发生催化氧化引入醛基。D与丙醛发生已知信息Ⅱ的反应生成E,则E的结构简式为
,即C首先发生水解反应氯原子被羟基代替,然后羟基发生催化氧化引入醛基。D与丙醛发生已知信息Ⅱ的反应生成E,则E的结构简式为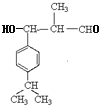 ,E发生消去反应生成F,则F的结构简式为
,E发生消去反应生成F,则F的结构简式为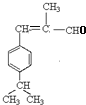 ,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中碳碳双键与氢气加成,故F中碳碳双键、-CHO与氢气加成生成G,G中醇被氧化为-CHO,则G为
,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中碳碳双键与氢气加成,故F中碳碳双键、-CHO与氢气加成生成G,G中醇被氧化为-CHO,则G为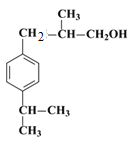 、H为
、H为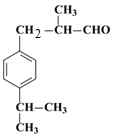 。
。
(1)根据以上分析可知D的结构简式为 ,E中含有的官能团名称为羟基、醛基。(2)根据以上分析可知反应物a的结构简式为CH2=CHCH3,该反应的反应类型为加成反应;(3)C首先发生水解反应氯原子被羟基代替,然后羟基发生催化氧化引入醛基,所以反应条件依次是NaOH水溶液/加热、O2/Cu加热;(4)根据以上分析可知F→G的反应类型为加成反应,G→H的化学方程式为
,E中含有的官能团名称为羟基、醛基。(2)根据以上分析可知反应物a的结构简式为CH2=CHCH3,该反应的反应类型为加成反应;(3)C首先发生水解反应氯原子被羟基代替,然后羟基发生催化氧化引入醛基,所以反应条件依次是NaOH水溶液/加热、O2/Cu加热;(4)根据以上分析可知F→G的反应类型为加成反应,G→H的化学方程式为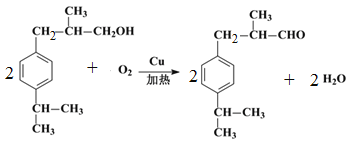 。(5)兔耳草醛H中的含氧官能团易被氧化,生成化合物W,W中含有羧基,G与W可发生酯化反应,反应的化学方程式为
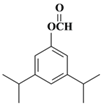
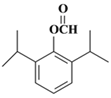
。(5)兔耳草醛H中的含氧官能团易被氧化,生成化合物W,W中含有羧基,G与W可发生酯化反应,反应的化学方程式为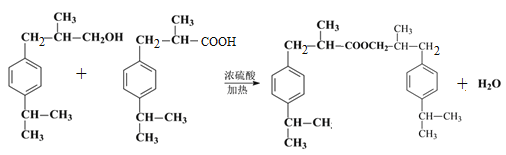 。(6)a.属于芳香族化合物且苯环上有三个取代基;b.1 mol该物质最多可消耗2molNaOH;c.能发生银镜反应,因此应该是甲酸和酚羟基形成的酯基;d.核磁共振氢谱有5组峰(面积为12:2:1:2:1),则符合条件的有机物结构简式为
。(6)a.属于芳香族化合物且苯环上有三个取代基;b.1 mol该物质最多可消耗2molNaOH;c.能发生银镜反应,因此应该是甲酸和酚羟基形成的酯基;d.核磁共振氢谱有5组峰(面积为12:2:1:2:1),则符合条件的有机物结构简式为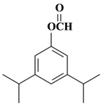 、
、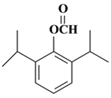 。
。


科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,如图是用固体氧化物作“直接煤燃料电池”的电解质。下列有关说法正确的是( )

A. 电极b为电池的负极 B. 电子由电极a沿导线流向b
C. 电池反应为C+CO2===2CO D. 煤燃料电池比煤直接燃烧发电能量利用率低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)![]() COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 石英砂可用于生产单晶硅
B. 大多数金属在常温下是固体
C. 可用氢氟酸在玻璃器皿上刻蚀标记
D. 飞机机身的材料大多是以金属为增强体、纤维为基体的复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.0g沉淀,对样品所含杂质的正确判断是( )
A.肯定有KNO3和Na2CO3 , 没有Ba(NO3)2
B.肯定有KNO3 , 没有Ba(NO3)2 , 可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2 , 可能有KNO3
D.以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证SO2的性质,某同学利用输液管设计了如下微型实验:
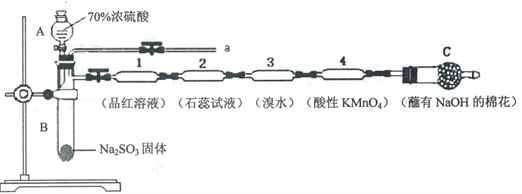
请回答:
(1)仪器A的名称是_________________。
(2)装置C中NaOH的作用是_________________。
(3)下列说法正确的是_________________。
A.装置l、3、4中溶液均褪色,可证明SO2具有漂白性
B.装置2中石蕊试液只变红不褪色,证明SO2是一种酸性氧化物
C.反应结束后,可由a导管向装置中加水,将气体赶出后再拆装置
D.在a导管处用向下排空气法收集SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A. Cl2的摩尔质量为71
B. 12C、13C、14C是碳元素的三种核素,互称为同位素
C. 0.012kg12C中所含的原子数称为阿伏加德罗常数
D. 卢瑟福根据α粒子散射实验,提出了带核的原子结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mgX气体,X由双原子分子构成,它的摩尔质量为Mgmol﹣1 . 若用NA表示阿伏加德罗常数的值,则:
(1)该气体的物质的量为;
(2)该气体中所含原子总数为个;
(3)该气体在标准状况下的体积为L;
(4)该气体溶于1L水中(不考虑反应),所得溶液密度为ρgcm﹣3 , 溶液中X的物质的量浓度为mol/L.
(5)已知X气体在水中易溶,通常1L水能溶解500L X气体.常温常压下将充满X气体的500mL集气瓶倒扣入足量水中,集气瓶中得到的溶液中X的物质的量浓度为(常温常压下气体摩尔体积为Vm , 不考虑集气瓶中溶液向水中扩散).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com