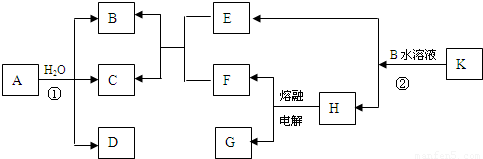
【答案】
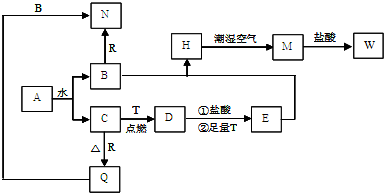
分析:以上物质均由短周期元素组,已知C为淡黄色固体,结合转化关系分析,是A和水反应的生成产物,判断为S,B、D、E、F标况下均为气体,且水溶液均呈酸性,其中F为单质,G为常见金属,G在CO
2中燃烧生成白色和黑色两种固体,依据所学可知G是Mg,H为MgCl
2,F为Cl
2,EF反应生成BC,E中一定含硫元素,B、D、E、F标况下均为气体,且水溶液均呈酸性,推断E为H
2S,K是正盐,K+B=H(MgCl
2)+E(H
2S),推断K为MgS,B为HCl,A的分子结构和H
2O
2相似,且均满足8电子结构,A+H
2O=B(HCl)+C(S)+D,分析可知,A中含氯元素和硫元素,推断S
2Cl
2;依据氧化还原反应存在的电子守恒和原子守恒得到D为SO
2,综上所述:A为S
2Cl
2;B为HCl;C为S;D为SO
2;E为H
2S;F为Cl
2;G为Mg;H为MgCl
2;K为MgS.
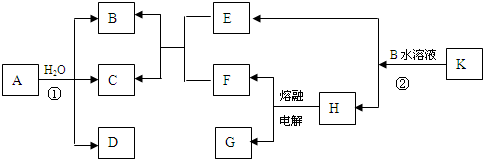
解答:解:以上物质均由短周期元素组,已知C为淡黄色固体,结合转化关系分析,是A和水反应的生成产物,判断为S,B、D、E、F标况下均为气体,且水溶液均呈酸性,其中F为单质,G为常见金属,G在CO
2中燃烧生成白色和黑色两种固体,依据所学可知G是Mg,H为MgCl
2,F为Cl
2,EF反应生成BC,E中一定含硫元素,B、D、E、F标况下均为气体,且水溶液均呈酸性,推断E为H
2S,K是正盐,K+B=H(MgCl
2)+E(H
2S),推断K为MgS,B为HCl,A的分子结构和H
2O
2相似,且均满足8电子结构,A+H
2O=B(HCl)+C(S)+D,分析可知,A中含氯元素和硫元素,推断S
2Cl
2;依据氧化还原反应存在的电子守恒和原子守恒得到D为SO
2,综上所述:A为S
2Cl
2;B为HCl;C为S;D为SO
2;E为H
2S;F为Cl
2;G为Mg;H为MgCl
2;K为MgS;
(1)B、D、E、F气体的水溶液中具有漂白能力的是:Cl
2和 SO
2;故答案为:Cl
2;SO
2;
(2)用电子式表示E(H
2S)分子的形成过程
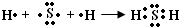
,
故答案为:
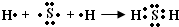
;
(3)从H为MgCl
2结晶水合物再进一步得到MgCl
2的无水物,为避免蒸发过程中镁离子的水解,应在干燥的HCl气流中加热,抑制水解程度得到氯化镁,故答案为:在干燥的HCl气流中加热;
(4)反应①为S2Cl2与水反应生成SO
2、S、H
2S,依据电子守恒和电子守恒写出配平反应的化学方程式为:2S
2Cl
2+2H
2O=3S+SO
2↑+4HCl; DSO
2和FCl
2反应离子方程式:Cl
2+SO
2+2H
2O=4H
++SO
42-+2Cl
-,
故答案为:2S
2Cl
2+2H
2O=3S+SO
2↑+4HCl;Cl
2+SO
2+2H
2O=4H
++SO
42-+2Cl
-.
点评:本题考查了物质转化关系的应用判断,物质性质的分析判断,主要考查反应条件,特征反应,特征物质的分析判断,突破口是G在CO
2中燃烧生成白色和黑色两种固体,F是淡黄色固体,题目难度中等.

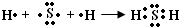 ,
,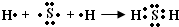 ;
;

 阅读快车系列答案
阅读快车系列答案