

分析 (1)硫酸四铵合铜晶体的制备过程中,加入95%乙醇可以降低硫酸四氨合铜晶体的溶解度,有利于晶体析出,静置析出晶体后,减压过滤,晶体用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,由于下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间,然后将其在60℃左右小心烘干,以防止硫酸四氨合铜蒸发浓缩过程,受热分解生成NH3,据此答题;
(2)步骤二装置中15mL 10% NaOH溶液加热样品,保持微沸状态1小时左右,可以使溶液中的氨气充分挥发出来,根据滴定用去的氢氧化钠的物质的量可以计算出与氨反应的盐酸的物质的量,进而计算产生的氨气的物质的量,再计算出NH3的质量百分数;如不使用空气冷凝管和冰水浴将使氨气,盐酸会挥发,则消耗的氢氧化钠会偏少,据此分析;
(3)根据中和滴定的原理,指示剂的变色点 的pH值要与滴定终点的pH值接近,据此选择指示剂;
(4)用稀硫酸洗涤硫酸钡沉淀,可以减小硫酸钡的损失,滤纸和硫酸钡沉淀一起灼烧,滤纸碳化后可以硫酸钡发生氧化还原反应,生成一氧化碳和硫化钡,据此答题;
解答 解:(1)硫酸四铵合铜晶体的制备过程中,加入95%乙醇可以降低硫酸四氨合铜晶体的溶解度,有利于晶体析出,静置析出晶体后,减压过滤,晶体用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,由于下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间,然后将其在60℃左右小心烘干,以防止硫酸四氨合铜蒸发浓缩过程,受热分解生成NH3,
故答案为:降低硫酸四氨合铜晶体的溶解度,有利于晶体析出;下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间;硫酸四氨合铜蒸发浓缩过程,受热分解可以生成NH3;
(2)步骤二装置中15mL 10% NaOH溶液加热样品,保持微沸状态1小时左右,可以使溶液中的氨气充分挥发出来,与盐酸反应的氢氧化钠的物质的量为0.500mol•L-1×0.022L=0.011mol,所以与氨反应的盐酸的物质的量为0.030L×0.500mol•L-1-0.011mol=0.004mol,则产生的氨气的物质的量为0.004mol,所以NH3的质量百分数为$\frac{0.004×17}{0.250}$×100%=27.2%,如不使用空气冷凝管和冰水浴将使氨气,盐酸会挥发,则消耗的氢氧化钠会偏少,根据上面的计算过程可知,计算出的氨的质量分数会偏高,
故答案为:将氨全部蒸出,从而得到准确的测量结果;27.2%; 偏高;
(3)根据中和滴定的原理,指示剂的变色点 的pH值要与滴定终点的pH值接近,根据图中变色点的pH值可知,应选择甲基红,故选B;
(4)用稀硫酸洗涤硫酸钡沉淀,可以减小硫酸钡的损失,沉淀溶解平衡的方程式为BaSO4(s)?Ba2+(aq)+SO42-(aq),滤纸和硫酸钡沉淀一起灼烧,滤纸碳化后可以硫酸钡发生氧化还原反应,生成一氧化碳和硫化钡,反应方程式为BaSO4+4C 高$\frac{\underline{\;高温\;}}{\;}$4CO↑+BaS,
故答案为:BaSO4(s)?Ba2+(aq)+SO42-(aq),洗净杂质的同时,SO42-浓度升高使BaSO4的沉淀溶解平衡逆向移动,减少BaSO4的溶解;BaSO4+4C 高$\frac{\underline{\;高温\;}}{\;}$4CO↑+BaS.
点评 本题考查了物质的制备实验方案的设计、物质组成的测定,题目难度中等,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力、计算能力及化学实验能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
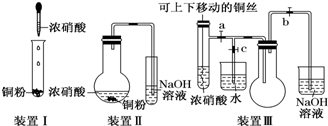
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
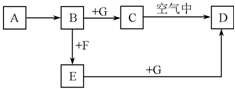 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥⑦⑧ | D. | ⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com