
溴及其化合物广泛应用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下:

①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是______。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
Br2+ Na2CO3 =
Na2CO3 = NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。
(2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
|
粒子 |
I2 |
Br2 |
IO3- |
|
物质的量/mol |
0.5 |
1.3 |
|
则原溶液中NaI的物质的量为______mol。
(1)①ⅰ.Cl2+2Br-=Br2+2Cl-
ⅱ.Cl2+H2O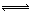 H++Cl-+HClO, 增大c(H+),平衡逆向移动,抑制Cl2与水反应
H++Cl-+HClO, 增大c(H+),平衡逆向移动,抑制Cl2与水反应
②3 3 1 3 5 NaBr
③盐酸有还原性,与溴酸根反应
(2)3
【解析】
试题分析:(1)①ⅰ.通入氯气后,Cl2与Br‾反应:Cl2+2Br-=Br2+2Cl-
ⅱ.Cl2与水的反应为可逆反应:Cl2+H2O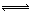 H++Cl-+HClO,降低溶液的pH,增大c(H+),平衡逆向移动,抑制Cl2与水反应。
H++Cl-+HClO,降低溶液的pH,增大c(H+),平衡逆向移动,抑制Cl2与水反应。
②根据化合价的变化和元素守恒可推知生成物为NaBr,有化合价升降法可配平化学方程式。
③HCl中Cl元素为-1价,为最低价态,所以盐酸具有还原性,能被溴酸根氧化,所溴的质量减少。
(2)根据氧化还原反应中得失电子数相等,可得5×2.6mol=2×0.5mol+6×n(IO3‾),则n (IO3‾)=2mol,根据元素守恒,原溶液中n(NaI)=0.5mol×2+2mol=3mol。
考点:本题考查离子方程式的书写、化学平衡移动、化学方程式的配平、根据电子守恒的计算。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
溴及其化合物在人类生产生活中有广泛应用。大量的溴用于制造感光材料和染料,化学试剂和医学药物等,家用药箱中的必备药品红汞就是溴汞化合物。
茫茫大海是溴的“故乡”,早在19世纪初,法国化学家就发明了提取溴的空气吹出法工艺,这个方法也是目前工业规模海水提滚的成熟方法。其工艺流程如下:
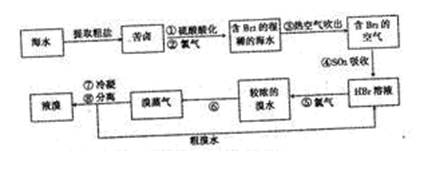
(1)步骤③中通入然空气而不是直接通入空气的原因是 。
(2)步骤④的化学反应方程式: 。
(3)步骤⑥的操作方法是 (填操作名称)。
(4)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
(5)将步骤③分离出的溴用碳酸钠吸收,得到溴化钠和溴酸钠的混合物,再酸化、蒸馏,就可得较纯的溴,过程中有两步主要反应,请写出第二步反应的离子方程式:
a.3Br2+3CO32-=5Br-+B2O3+3CO2↑
b.
现有1t含纯碱晶体(Na2CO3·10H2O)28.6%的工业废渣,可用于溴的生产。理论上可得到溴 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)=2 CuBr(s)+ Br2(g) △H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试化学(海南卷带解析) 题型:填空题
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)="2" CuBr(s)+ Br2(g) △H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试化学(海南卷解析版) 题型:填空题
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)="2" CuBr(s)+ Br2(g) △H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com