
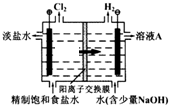
 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:分析 (1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH;
(2)阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(3)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后,盐酸加在最后;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
解答 解:(1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH,其电解离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;在阴极上溶液中生成NaOH,所以A的溶质为NaOH;
故答案为:NaOH;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
(2)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,
故答案为:Na+;Cl-、OH-;
(3)粗盐提纯时加试剂的原则是:氢氧化钠除去镁离子和三价铁离子,碳酸钠一定加在氯化钡之后,这样碳酸钠既可以除去钙离子又可以除去多余的钡离子,盐酸加在最后来除去多余的碳酸根离子和氢氧根离子,
故答案为:③②①④;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,方程式为:3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$5Cl-+ClO3-+3H2O;
故答案为:3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$5Cl-+ClO3-+3H2O.
点评 本题考查了电解原理的应用、离子方程式的书写,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握电解池中阴阳极上离子的放电顺序以及发生的反应.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示 | |
| B. | 平衡常数越大,表示化学反应速率越大 | |
| C. | 可以用化学平衡常数来定量描述化学反应的限度 | |
| D. | 平衡常数的大小与温度、浓度、压强、催化剂有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 石蕊 | 酚酞 | 石蕊 |
| 小烧杯中的溶液 | 浓盐酸 | 浓氨水 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | |
| SiCl4 | -70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
| Si3N4 | 1900 | - | 性质稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn|H2SO4(稀)|C | B. | Cu|CuSO4溶液|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com