
活性炭吸附法是工业提碘的主要方法之一。其流程如下:
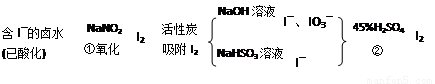
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3–
+ H2O H2SO3 + OH– 和
②
(写出离子方程式)
H2SO3 + OH– 和
②
(写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
(1)2I-+2NO2-+4H+=I2+2NO+2H2O 2e
(2)氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2
(3)碘在水中溶解度不大,且易升华 水浴加热
(4)富集碘元素
(5)HSO3–  H++SO32-
H++SO32-
逆向移动, pH值升高
正确,物料守恒
【解析】
试题分析:(1)根据氧化还原原理:离子方程式2I-+2NO2-+4H+=I2+2NO+2H2O,碘失电子给氮,转移电子 2e-。
(2)主要是氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因碘在水中溶解度不大,且易升华,所以,反应②需要在水浴加热条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是富集碘元素。
(5)流程中用到的NaHSO3溶液显弱酸性,由于亚硫酸的电离产生,离子方程式为HSO3–  H++SO32-。a.加入少量金属Na,钠与水生成了氢氧化钠,溶液中氢氧根浓度增大,平衡①向右移动,溶液的pH升高。b根据钠与硫的物料守恒关系,可知正确。
H++SO32-。a.加入少量金属Na,钠与水生成了氢氧化钠,溶液中氢氧根浓度增大,平衡①向右移动,溶液的pH升高。b根据钠与硫的物料守恒关系,可知正确。
考点:本题主要考查氧化还原反应的电子转移,实验原理分析,物料守恒关系的运用。


 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com