
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)= ![]() molL﹣1min﹣1
molL﹣1min﹣1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【答案】C
【解析】解答:A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol﹣0.8mol=0.4mol,v(CO)=  mol/(Lmin),速率之比等于化学计量数之比计算v(H2)=v(CO)=
mol/(Lmin),速率之比等于化学计量数之比计算v(H2)=v(CO)= ![]() mol/(Lmin),故A错误;B、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B错误;C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C正确;D、t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol﹣0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,则k=
mol/(Lmin),故A错误;B、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B错误;C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C正确;D、t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol﹣0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,则k= ![]() =1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动,故正反应为放热反应,故D错误;所以选C. 分析:本题是化学平衡问题,主要考查化学反应速率、化学平衡及平衡常数等计算,注意方法的分析应用.
=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动,故正反应为放热反应,故D错误;所以选C. 分析:本题是化学平衡问题,主要考查化学反应速率、化学平衡及平衡常数等计算,注意方法的分析应用.


科目:高中化学 来源: 题型:
【题目】在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是( )
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( ) 
A.该试剂的物质的量浓度为9.2molL﹣1
B.该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L
C.配制50mL 4.6molL﹣1的稀硫酸需取该硫酸12.5mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( ) 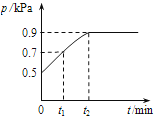
A.从反应开始到t1时的平均反应速率v(X)= ![]() mol/(Lmin)
mol/(Lmin)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)日本大地震和海啸造成核电站爆炸,发生核泄漏,使碘131、铯137等放射性核素扩散到空气和海洋中。碘131的原子核中,中子数与质子数之差为 , 铯元素位于元素周期表中第周期族。
(2)下列原子: ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 中共有种元素,种核素。
中共有种元素,种核素。
(3)在H3O+中,质子数、中子数、电子数之比为;在NH3D+中,质子数、中子数、电子数之比为。
(4)填写下列表格(Z——质子数,N——中子数,A——质量数):
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是( )

A.若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 molL﹣1s﹣1
B.t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C.B的起始物质的量为0.02 mol
D.该化学反应的表达式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是( ) 
A.普伐他汀分子中有4种含氧官能团
B.每个普伐他汀分子中含有13个手性碳原子
C.在一定条件下,普伐他汀能发生加成、取代、消去、缩聚反应
D.普伐他汀可以和NaOH溶液、Na2CO3溶液反应,还可以和酸性KMnO4溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com