
| A. |  | B. |  | C. |  | D. |  |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加稀盐酸生成无色气体,说明原溶液中有HCO3- | |
| B. | 向某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有CO32- | |
| C. | 向某溶液中加NaOH溶液微热,产生使湿润的红色石蕊试纸变蓝说明原溶液中有NH4+ | |
| D. | 向某溶液中加稀硫酸生成白色沉淀,说明原溶液中有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
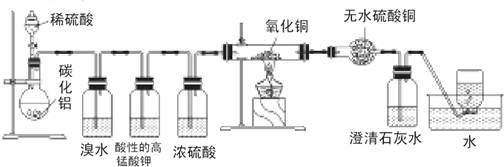
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键既存在于相邻原子之间,又存在与相邻分子之间 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 相邻原子之间的强相互作用 | |
| D. | 共价键只能存在于共价化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入合金的质量不可能为5 g | |
| B. | 参加反应的硝酸的物质的量为0.1 mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为150 mL | |
| D. | 溶解合金时收集到NO气体的体积在标准状况下约为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该绿色食品中不含任何化学物质 | |
| B. | 用蒸馏法可从海水中获得淡水 | |
| C. | ag碳和bg氧气完全反应,一定生成(a+b)g的二氧化碳 | |
| D. | 用规格为10mL的量筒量取6.2mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧有浓烟 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 能与溴发生1:2加成反应 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com