
下列关于氯水的说法正确的是( )
A、向氯水中通入少量二氧化硫,氯水的漂白性增强
B、氯水中加入NaCl固体,对溶液的pH无影响
C、常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L
D、向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、 NO3-、Cl-
C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42-
D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:推断题
弹性涤纶是一种新型聚酯纤维,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
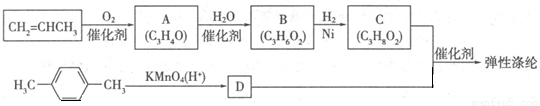
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,B中所含官能团的名称为 。
(2)由物质C与D反应生成弹性涤纶的化学方程式为 。
(3)由物质B到C的化学反应类型为 。
(4)写出C与足量钠反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
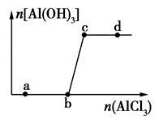
A.a点对应的溶液中:Na+、Fe3+、SO42- 、HCO3-
B.b点对应的溶液中:Ag+、Ca2+、NO3- 、F-
C.c点对应的溶液中:Na+、S2-、SO42- 、Cl-
D.d点对应的溶液中:K+、NH4+ 、I-、 CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:推断题
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:
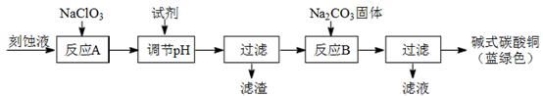
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
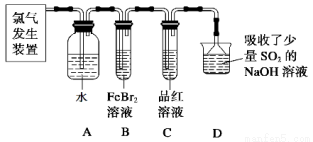
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是 。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:填空题
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为40,B、W同周期,D、E同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素的盐酸盐或硫酸盐可以用来净水,原理是_______________________(文字表述)。
(2)A2W2的分子中所含的化学键为________、________,经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃,DA能与水反应放氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是__________________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1∶2,且无气体生成,则该反应的离子方程式为____________________。
(6)在常温下用气体密度测定BW2的相对分子质量,实验值比理论值偏________(填 “高”或“低”),其原因是___________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
关于下列各实验装置的叙述中,不正确的是
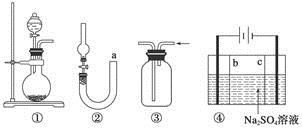
A.装置①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验装置②的气密性
C.实验室可用装置③收集H2、NH3
D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
下列有关化学用语表示正确的是
A.乙醛的结构简式:CH3COH
B.H2O2的电子式:
C.次氯酸的电子式: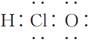
D.亚硫酸钠水解的离子方程式:SO32-+2H2O H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
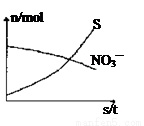
A.配平后氧化剂与还原剂的化学计量数之比为1:4
B.硫元素在反应中被还原
C.还原剂是含NH4+的物质
D.若生成1molNH4+,则转移电子2mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com