
| A | B | C | D | |
| 原子晶体 | 石墨 | 生石灰 | 碳化硅 | 金刚石 |
| 分子晶体 | 冰 | 固态氨 | 氯化铯 | 干冰 |
| 离子晶体 | 氮化铝 | 食盐 | 明矾 | 芒硝 |
| 金属晶体 | 铜 | 汞 | 铝 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
分析 相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;由离子键结合的物质为离子晶体;由分子构成的物质为分子晶体;金属晶体由金属离子和自由电子构成,以此解答该题.
解答 解:A.生石灰为CaO,为离子晶体,故A错误;
B.氯化铯为活泼金属的氯化物,为离子晶体,故B错误;
C.氮化铝常用作砂轮及耐高温的材料,熔融时不导电为共价化合物,熔点高、硬度大,为原子晶体,故C错误;
D.金刚石为原子晶体,干冰为二氧化碳,属于分子晶体,芒硝为硫酸钠,属于离子晶体,铁为金属晶体,故D正确.
故选D.
点评 本题考查不同晶体的区别,为高频考点,侧重于双基的考查,注意把握晶体的类型和识别,注重相关基础知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
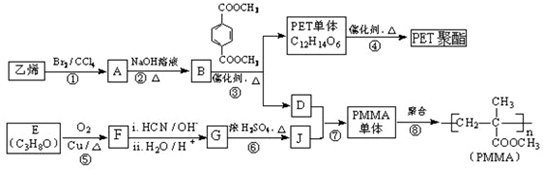
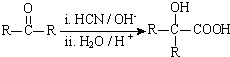 (R、R′代表烃基)
(R、R′代表烃基)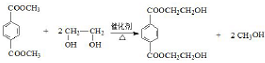 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、H+、Cl- | B. | K+、CO32-、OH- | C. | Cl-、CO32-、OH- | D. | K+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| B. | 2.24LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| C. | 78g苯含有C=C双键的数目为3NA | |
| D. | 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b和c分别与a形成化合物的相对分子质量一定为b>c | |
| B. | a和d形成的化合物与水反应产生的气体可做燃料 | |
| C. | +6价的c和a、b形成离子化合物 | |
| D. | a、b、c和d四种元素组成的化合物的水溶液加入少量Na2CO3只产生气体,不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
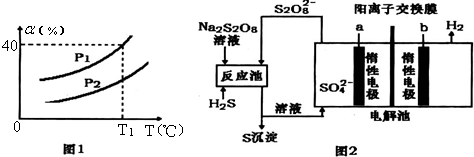
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com