
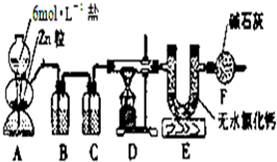
 实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.
实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物. 2Fe+3H2O,H2+FeO
2Fe+3H2O,H2+FeO Fe+H2O,
Fe+H2O, 2Fe+3H2O,H2+FeO
2Fe+3H2O,H2+FeO Fe+H2O;
Fe+H2O;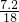 mol=0.4mol,
mol=0.4mol,

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:阅读理解
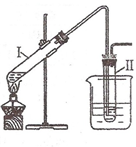 (2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.
(2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.| △ |
| △ |
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 1 | 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. |
液体分层,上层可能含有NaOH及NaBr. 液体分层,上层可能含有NaOH及NaBr. |
| 2 | 取上层清夜于小试管中,加入过量的稀硝酸酸化. 取上层清夜于小试管中,加入过量的稀硝酸酸化. |
无明显现象. 无明显现象. |
| 3 | 取少许酸化后的溶液用pH试纸检验. 取少许酸化后的溶液用pH试纸检验. |
pH试纸呈红色,溶液呈酸性. pH试纸呈红色,溶液呈酸性. |
| 4 | 向上述酸化的溶液中滴加AgNO3溶液. 向上述酸化的溶液中滴加AgNO3溶液. |
有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
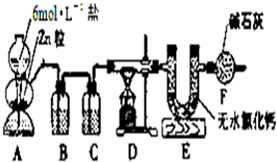 实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.
实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2015届山西省高一上学期期末联考化学试卷(A)(解析版) 题型:实验题
(16分)硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是 (填写字母标号)。

(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为 mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需 和 。
(3)用图所示的实验装置验证铜与浓硫酸反应生成的气体产物,则装置②、③分别为 。
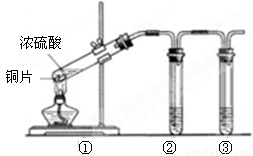
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为 ,
若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为品红溶液, 装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为 。装置②中的现象是 。根据装置③观察到有白色沉淀生成的现象 , (填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com