


科目:高中化学 来源: 题型:阅读理解
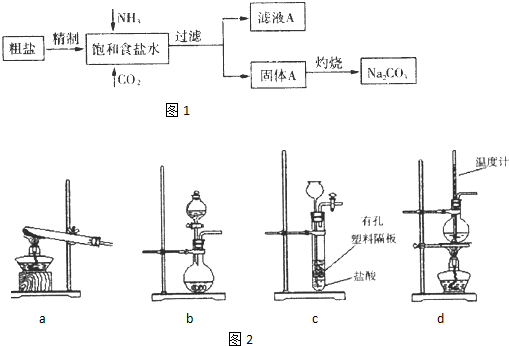
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
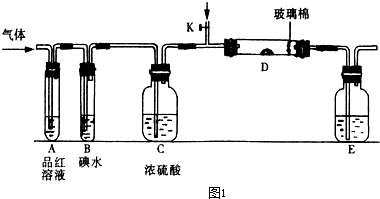
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(20分)
Ⅰ 以下是有关SO2、Cl2的性质实验。
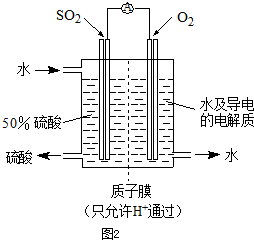
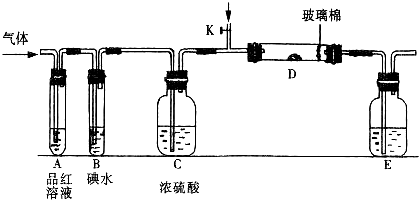
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
① 若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为 。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,仍然无法观察到沉淀产生。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
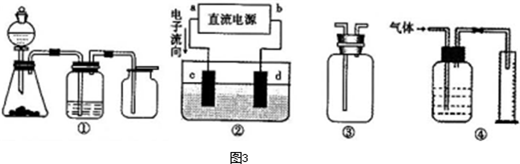
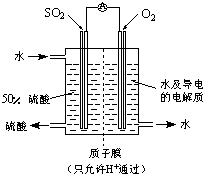
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如上图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为 ;电池的总反应式
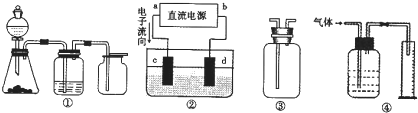
Ⅱ 实验是化学研究的基础,关于下列各装置图的叙述正确的是 (填序号)
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
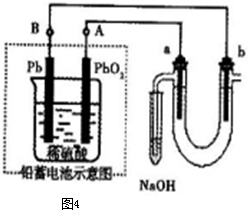
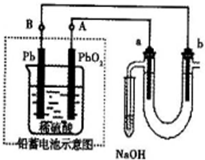
Ⅲ 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 (填序号)
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
查看答案和解析>>
科目:高中化学 来源:2011届山东省潍坊三县高三阶段性教学质量检测化学试卷 题型:实验题
(20分)
Ⅰ 以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
① 若从左端分别通 入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的
入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的 是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为 。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,仍然无法观察到沉淀产生。
A.氨水 B.稀盐 酸 C.硝酸钾溶
酸 C.硝酸钾溶 液 D.硫化钠溶液
液 D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出C l2与含X的溶液反应的离子方程式 。
l2与含X的溶液反应的离子方程式 。
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如上图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为 ;电池的总反应式
Ⅱ 实验是化学研究的基础,关于下列各装置图的叙述正确的是 (填序号)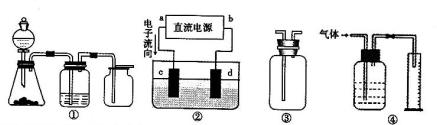
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中 ,a为正扳,d为阳极
,a为正扳,d为阳极
C.装置③可用于收集H 2、NH3、Cl2,、HCl、NO2等
2、NH3、Cl2,、HCl、NO2等
D .装置④能用于测量气体体积
.装置④能用于测量气体体积
Ⅲ 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 (填序号)
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com