
分析 根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;碳酸根离子水解平衡常数表达式为$\frac{[O{H}^{-}]•[HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$,据此分析.
解答 解:根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.2molCO2和100mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是相同浓度的碳酸钠和碳酸氢钠的混合物;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大于碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
碳酸根离子水解平衡常数表达式为$\frac{[O{H}^{-}]•[HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$,pH=a,则c(OH-)=10a-14mol/L,所的溶液是相同浓度的碳酸钠和碳酸氢钠的混合物,水解都很微弱,所以碳酸根离子和碳酸氢根离子浓度大约相等,则碳酸根离子水解平衡常数为10a-14mol/L,
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);10a-14mol/L.
点评 本题考查了离子浓度大小比较和水解平衡常数的求算,注意二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L1 mol•L-1硫酸中所含的氧原子数为4NA | |
| B. | 标准状况下,11.2LCCl4所含的原子数为2.5NA | |
| C. | 2.3gNa中所含的电子数为1.1NA | |
| D. | 常温常压下,14g由N2与CO组成对混合气体中所含对原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠、碳酸氢钠 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
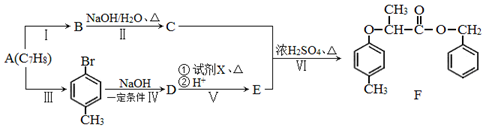
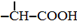 $→_{红磷、△}^{Cl_{2}}$
$→_{红磷、△}^{Cl_{2}}$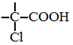
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
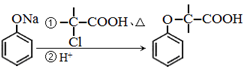
.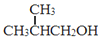 为原料制取
为原料制取 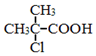 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
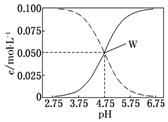 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
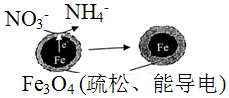
| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氯元素被氧化 | |
| B. | NaCN既是氧化剂又是还原剂 | |
| C. | 生成0.lmol N2,转移1mol电子 | |
| D. | 氧化产物与还原产物的物质的域之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述Ⅱ |
| A | HClO具有强氧化性 | HClO有杀菌消毒作用 |
| B | 铝比铁活泼 | 铝比铁更容易被腐蚀 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | 浓硝酸具有强氧化性 | 浓硝酸能和浓氨水反应产生白烟 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com