
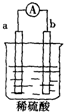
 如图所示的装置中,a在金属活动顺序表中位于氢前,b为碳棒,关于此装置的各种叙述不正确的是( )
如图所示的装置中,a在金属活动顺序表中位于氢前,b为碳棒,关于此装置的各种叙述不正确的是( )| A、导线中有电子流动,电子从a极流到b极 |
| B、碳棒上有气体放出,溶液pH变大 |
| C、a极上发生了氧化反应 |
| D、a是正极,b是负极 |


科目:高中化学 来源: 题型:
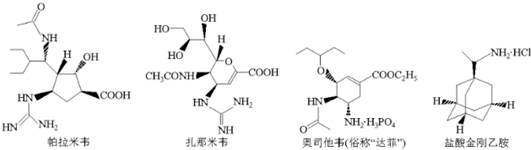
| A、帕拉米韦的分子式为C15H27N4O4 |
| B、扎那米韦与帕拉米韦的钠盐可用新制Cu(OH)2悬浊液鉴别 |
| C、1mol达菲最多能与5molNaOH反应 |
| D、盐酸金刚乙胺六元环上的一个氢原子被氯原子取代,所得一氯代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用广泛pH试纸测得某溶液的pH为3.4 |
| B、用10mL量筒量取8.8mL NaOH溶液 |
| C、用托盘天平称量7.9g NaCl固体 |
| D、用酸式滴定管量取18.00mL HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、既能溶解Al(OH)3,又能溶解H2SiO3的溶液:Na+、Fe2+、SO42-、Cl- |
| B、强碱性溶液中:Cl-、SO32-、HSO3-、Na+ |
| C、c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br- |
| D、含有大量Fe3+的溶液:Na+、Al3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知原子的核电荷数,可以推知该原子的周期序数 |
| B、原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数 |
| C、知道原子的周期序数,就能确定该元素在周期表中的位置 |
| D、知道原子的周期序数,还不能确定该元素在周期表中的位置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
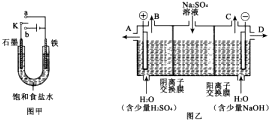 (1)某课外活动小组同学用图甲装置进行实验,试答下列问题:
(1)某课外活动小组同学用图甲装置进行实验,试答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放在足量水中 |
| B、放在足量盐酸中 |
| C、放在足量CuSO4溶液中 |
| D、用刺有小孔的铝,包好放入足量水底中(假设铝不参加反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该化合物是共价化合物 |
| B、化合物N5AsF6中As化合价为+1 |
| C、N5+共有34个核外电子 |
| D、N5+中氮-氮原子间以共用电子对结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1120 | B、2240 |
| C、560 | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com