
| A. | 增加H2的量 | |
| B. | 将容器体积缩小一半 | |
| C. | 保持容器内体积不变,充入Ar使体系压强增大 | |
| D. | 充入Ar,保持容器内压强不变 |
分析 体积可调的密闭容器中,改变纯固体的量反应速率不变或气体的浓度不变,则反应速率不变,以此来解答.
解答 解:A、增加氢气的量,体积变大,水蒸气的浓度变小,反应速率改变,故A错误;
B、将容器体积缩小一半,体积缩小各组分的浓度都变大,反应速率加快,故B错误;
C、保持容器内体积不变,充入Ar使体系压强增大,但反应气体的浓度不变,反应速率不变,所以反应速率几乎无影响,故C正确;
D、充入Ar,保持容器内压强不变,体积变大,各组分的浓度减小,所以反应速率变小,故D错误;
故选C.
点评 本题考查影响化学反应速率的因素,为高频考点,把握常见的影响反应速率的外界因素为解答的关键,注意浓度不变时反应速率不变,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
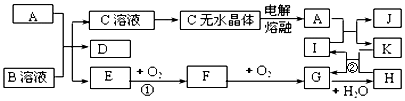
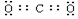 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
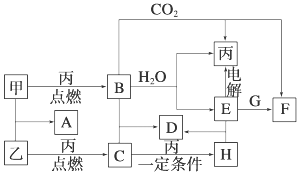
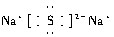 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.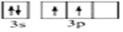 .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
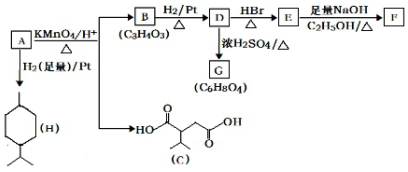
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$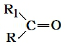 +R2COOH
+R2COOH .
.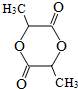 .
.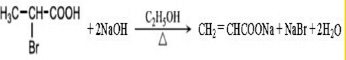 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| B. | 苹果放在空气中久置变黄和纸张在空气中久置变黄原理相似 | |
| C. | 从海水中提取物质,都必须经过化学反应才能实现 | |
| D. | 焙制糕点的发酵粉主要成分之一是碳酸氢纳,它也是治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++Cu=2Fe2++Cu2+成立说明氧化性:Fe3+>Cu2+ | |
| B. | 25℃,pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6g铁与足量的氯气反应失去电子为0.2mol | |
| D. | 硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入镁粉的质量/克 | 1 | 2 | 3 | 4 | 5 | 6 |
| 生成硫酸镁的质量/克 | 5 | m1 | 15 | 18 | m2 | 18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com