
| A. | CH4和C4H8 | B. | CH4和C3H6 | C. | C2H6和C3H6 | D. | C2H6和C4H8 |
分析 根据1升碳原子数为n的烷烃或烯烃充分燃烧后均得到n升CO2,由题意(1升混合气体充分燃烧后生成2.5升CO2,且B分子的碳原子数比A分子的多)可推断,混合气体只能由碳原子数小于2.5的烷烃(CH4和C2H6)和碳原子数大于2.5的烯烃(C3H6和C4H8)组成,它们有四种可能的组合,根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,利用十字交叉法可确定A和B的体积比.最后根据燃烧方程式利用差量法来计算.
解答 解:因1升混合气体充分燃烧后生成2.5升CO2,且B分子的碳原子数比A分子的多,混合气体只能由碳原子数小于2.5的烷烃(CH4和C2H6)和碳原子数大于2.5的烯烃(C3H6和C4H8)组成.它们有四种可能的组合:CH4、C3H6;CH4、C4H8;C2H6、C3H6;C2H6、C4H8,
根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,可确定A和B的体积比,
如: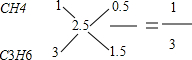 ,则V(CH4):V(C3H6)=1:3,
,则V(CH4):V(C3H6)=1:3,
①CH4、C4H8 1:1;
②CH4、C3H6 1:3;
③C2H6、C3H6 1:1;
④C2H6、C4H8 3:1;
设1升气态烃与氧充分燃烧后体积变化为△V升,则
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O(气)△V1=0(升)
C2H6+$\frac{7}{2}$O2$\stackrel{点燃}{→}$2CO2+3H2O(气)△V2=0.5(升)
C3H6+$\frac{9}{2}$O2$\stackrel{点燃}{→}$3CO2+3H2O(气)△V3=0.5(升)
C4H8+6O2$\stackrel{点燃}{→}$4CO2+4H2O(气)△V4=1.0(升)
各种组合的1升混合气体与氧气充分燃烧,体积增大为
组合①$\frac{△{V}_{1}+△{V}_{4}}{2}$=0.5(升),则 $\frac{0.5}{10}$×100%=5%,
组合②$\frac{△{V}_{1}+3△{V}_{3}}{4}$=0.375(升),则 $\frac{0.375}{10}$×100%=3.75%,
组合③$\frac{△{V}_{2}+△{V}_{3}}{2}$=0.5(升),则 $\frac{0.5}{10}$×100%=5%,
组合④$\frac{3△{V}_{2}+△{V}_{4}}{4}$=0.625(升),则 $\frac{0.625}{10}$×100%=6.25%,
故组合④符合题意,即A为C2H6,B为C4H8,
故选D.
点评 本题主要考查了混合物反应混合物反应的计算,题目难度较大,明确十字交叉法、差量法的使用方法为解答关键,注意根据燃烧的方程式进行判断,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题
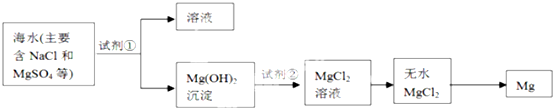
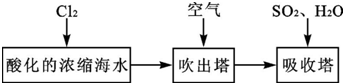
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 0.1 mol•L-1的NH4Cl与0.1 mol•L-1的NH3•H2O等体积混合:c(NH4+)+2c(H+)=c(NH3•H2O)+2c(OH-) | |
| C. | pH=9.4、浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) | |
| D. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1,有 NA个水分子生成且为 液体时,吸收1300 kJ的能量 | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
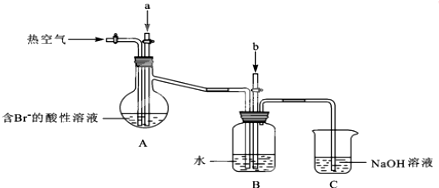
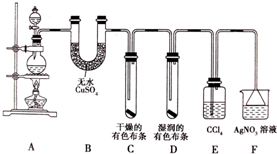 某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化 | |
| B. | 若pH(HA)+pH(BOH)=14,则V1=V2时,酸碱恰好完全中和 | |
| C. | 此混合液中:2c(H+)+c(B+)≤c(OH-)+c(A-) | |
| D. | 若混合溶液中c(B+)=c(A-),则此溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com