������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��1������ȼ����ֵ�ߣ�ʵ���ã��ڳ��³�ѹ�£�1g H
2��ȫȼ������Һ̬ˮ���ų�142.9kJ��������H
2ȼ�յ��Ȼ�ѧ����ʽΪ
H
2��g��+
O
2��g��=H
2O��1����H=-285.8kJ/mol
H
2��g��+
O
2��g��=H
2O��1����H=-285.8kJ/mol
��
��2������ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ����������ȼ�ϵ�ؽ���ͼ1��ʾʵ�飺

������ȼ�ϵ���У������ĵ缫��ӦʽΪ
O2+2H20+4e-=4OH-
O2+2H20+4e-=4OH-
��
����ͼװ���У�ijһͭ�缫����������3.2g����a�������ĵ�O
2�ڱ�״���µ����Ϊ
0.56
0.56
L��
��3�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�����ʽ���£�N
2��g��+3H
2��g��?2NH
3��g������H=-92.4kJ/mol
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N
2��H
2��NH
3����������Ӧ������ʱ��Ĺ�ϵ��ͼ2��ʾ��ͼ2��t
1ʱ����ƽ���ƶ�������������
����ѹǿ
����ѹǿ
�����б�ʾƽ��������NH
3�ĺ�����ߵ�һ��ʱ����
t2-t3
t2-t3
����t
0-t
1��t
1-t
3��t
3-t
5������ƽ�ⳣ���ֱ���K
1��K
2��K
3��ʾ����ôK
1��K
2��K
3�Ĵ�С��ϵ��
K1=K2��K3
K1=K2��K3
��
�����ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��
����
����
�ƶ�������������ҡ���������ʹ�ô�����Ӧ�ġ�H
���ı�
���ı�
�����������С�����ı䡱����
�¶�ΪT��ʱ����2a mol H
2�� a mol N
2����0.5L�ܱ������У���ַ�Ӧ����N
2��ת����Ϊ50%����Ӧ��ƽ�ⳣ��Ϊ
��




 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
 ������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�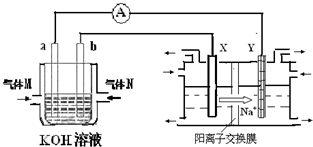 ��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
 ��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�