
实验室需配制一种溶液,除水电离出的离子外还含有五种离子,且在该溶液中这五种离子的物质的量浓度均为l mol·L-1,下面四个选项中,能达到此要求的是
A.Al3+、K+、SO42-、Cl-、HCO3- B.Fe2+、H+、Br-、NO3—、Cl-
C.Na+、K+、SO42-、NO3—、Cl- D.Al3+、Na+、Cl-、SO42-、NO3—
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.乙烯可以用来做果实催熟剂
B.氨常用来做制冷剂
C.氧化铁常用作红色油漆和涂料
D.浓硫酸可用来干燥某些气体(不挥发性)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca2++2ClO—=CaCO3↓+2HClO
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3—=CO32—+H2O
C.Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO3—+Ca2++OH—=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中化学试卷(解析版) 题型:选择题
下列有关物质的性质和应用的说法均正确的是
A.二氧化硅能与NaOH溶液反应,不能用玻璃瓶盛放NaOH溶液
B.Cl2能与Ca(OH)2反应,可以用澄清石灰水吸收尾气中的Cl2
C.CaCO3、BaSO4都难溶于水,均可用做钡餐
D.Al与Fe2O3能发生铝热反应,可用于焊接钢轨
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:填空题
(8分)某工业废水中,除H+、OH-外仅含下表离子中的几种。
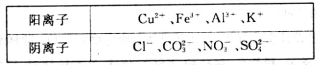
甲同学欲探究废水的组成,进行了如下实验:
I.取少量废水样品,加入KSCN溶液无明显变化。
II.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解。
请回答下列问题:
(1)废水中一定含有的金属阳离子是___________(填离子符号)。
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是____________________________。
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的________(填离子符号),其判断理由是_________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
C、N、S都是重要的非金属元素。下列说法中,正确的是
A.三者对应的氧化物均为酸性氧化物
B.三者的单质直接与氧气反应都能生成两种以上氧化物
C.同浓度的Na2CO3溶液、NaNO3溶液、Na2SO3溶液的pH比较:NaNO3溶液<Na2SO3溶液<Na2CO3溶液
D.CO2、NO2、SO2都能与H2O发生化合反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法中,正确的是
A.1mol Na被氧化完全转化生成Na2O2,失去电子数为2NA
B.常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA
C.将lmL 1 mol·L-1 FeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA
D.标准状况下,6.72L NO2与足量水充分反应转移的电子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:填空题
(10分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中
 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:选择题
仅用下表提供的仪器和药品,就能达到相应实验目的是
编号 | 仪器 | 药品 | 实验目的 |
A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分数的NaCl溶液 |
B | 分液漏斗、锥形瓶、试管、 导管及橡皮塞 | 浓硝酸、碳酸钠固体、硅酸钠溶液 | 证明酸性:硝酸>碳酸>硅酸 |
C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
D | 烧杯、分液漏斗、胶头滴管、铁架台 | 混有苯酚杂质的苯、浓溴水 | 提纯混有苯酚杂质的苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com