
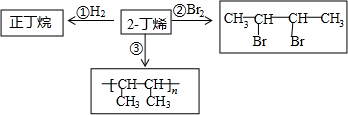
分析 (1)正丁烷主链有4个碳的烷烃;同分异构体是分子式相同,但结构不同的化合物,丁烷的两种同分异构体分别为主链含4个C的丁烷、主链为3个C的2-甲基丙烷;
(2)甲烷与氯气光照下发生取代反应生成一氯甲烷和HCl;
(3)2-丁烯与溴发生加成反应生成2,3-二溴丁烷;
解答 解:(1)正丁烷主链有4个碳的烷烃,结构简式为:CH3(CH2)2CH3;正丁烷的同分异构体为异丁烷,结构简式为(CH3)2CHCH3;
(2)甲烷与氯气光照下发生取代反应生成一氯甲烷和HCl,反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代反应;
(3)2-丁烯与溴发生加成反应生成2,3-二溴丁烷,化学方程式:CH3-CH═CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
故答案为:CH3-CH═CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
点评 本题考查了有机物结构简式、同分异构体的书写,化学方程式的书写,熟悉常见有机物结构特点及性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量与白色固体的质量均保持不变 | |
| B. | 溶液浓度和pH值均保持不变,溶液下部是1.73g氢氧化钡固体 | |
| C. | 溶液中钡离子与氢氧根离子的数目均保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 | |
| D. | 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
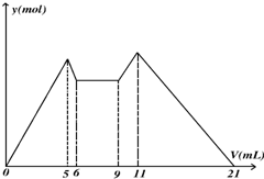
| A. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| B. | A是NaOH,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| C. | 若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、H+、Na+、NO3- | B. | H+、Ag+、Cl-、SO42- | ||
| C. | K+、Na+、OH-、SO42- | D. | Ba2+、Ca2+、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com