
| A. | 若锌粉有剩余,则不溶物中一定有铜,可能有铁 | |
| B. | 若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ | |
| C. | 若锌粉无剩余,且溶液中尚存有Cu2+,则一定有Fe2+ | |
| D. | 若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+ |
分析 在溶液中的氧化性Fe3+>Fe2+>Zn2+,所以在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉,发生的反应先后顺序为:2Fe3++Zn=2Fe2++Zn2+,Cu2++Zn=Cu+Zn2+,Fe2++Zn=Fe+Zn2+,据此分析解答.
解答 解:在金属活动性顺序中,锌>铁>氢>铜,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,所以在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉,发生的反应有:Cu2++Zn=Cu+Zn2+,在溶液中的氧化性Fe3+>Fe2+>Zn2+,所以2Fe3++Zn=2Fe2++Zn2+,Fe2++Zn=Fe+Zn2+,
A.若锌粉有剩余,说明溶液中一定没有Fe3+、Fe2+、Cu2+,则不溶物中一定有铜和铁,故A错误;
B.若锌粉有剩余,说明溶液中一定没有Fe3+、Fe2+、Cu2+,则溶液中的金属阳离子只有Zn2+,故B正确;
C.发生的反应先后顺序为:2Fe3++Zn=2Fe2++Zn2+,Cu2++Zn=Cu+Zn2+,Fe2++Zn=Fe+Zn2+,若锌粉无剩余,且溶液中尚存有Cu2+,Fe2++Zn=Fe+Zn2+,一定没有发生,则一定有Fe2+,故C正确;
D.若锌粉无剩余,且溶液中无Cu2+,2Fe3++Zn=2Fe2++Zn2+,Cu2++Zn=Cu+Zn2+,一定发生,Fe2++Zn=Fe+Zn2+,可能发生,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+,故D正确;
故选A.
点评 本题考查了Fe3+、Fe2+、Zn2+氧化性强弱的应用,依据金属活动性顺序以及氧化性Fe3+>Fe2+>Zn2+是解答的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠固体保存在配有橡皮塞的细口瓶中 | |
| B. | 将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明有漂白性 | |
| C. | 不能在石英坩埚中熔化氢氧化钠 | |
| D. | 用湿润的pH试纸测定稀盐酸的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
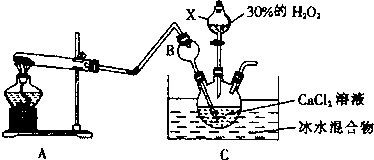
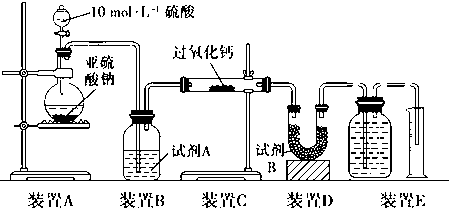
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水与氯化铝溶液反应产生氢氧化铝沉淀 | |
| B. | 用氨水做导电实验,灯泡很暗 | |
| C. | 0.1mol/L的氨水的pH<13 | |
| D. | 氯化铵溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O══Al(OH)3↓+3NH4+ | |
| C. | Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸钠与氢氧化钠:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅可用于制造光导纤维 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com