
对于室温下pH=3的醋酸,下列叙述正确的是
A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强
B.c(H+)=c(CH3COO-)+c(OH-)
C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)∙ c(H+)/c(CH3COOH)不变
D.与等体积pH=11的NaOH溶液混合后,pH=7
BC
【解析】
试题分析:醋酸溶液存在如下平衡:CH3COOH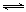 H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)∙ c(H+)/c(CH3COOH)不变,因为c(CH3COO-)∙ c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)∙ c(H+)/c(CH3COOH)不变,因为c(CH3COO-)∙ c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
考点:考查弱电解质的电离平衡、溶液的pH、溶液中离子浓度关系等。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源:菏泽二模 题型:单选题
| A.向该溶液中加入同温同体积pH=13的Ba(OH)2溶液,反应后溶液呈中性 |
| B.该溶液中硫酸电离出的c(H+)与水电离出的c(H+)之比为10-10 |
| C.等体积的该硫酸与室温下pH为1的硫酸中和碱的能力相同 |
| D.该溶液中水电离出的c(H+)是同温下pH为3的硫酸中水电离出的c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源:2012年山东省菏泽市高考化学二模试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com