
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
![]() ,据此回答以下问题:
,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。
【答案】(1)① ![]() (2分) ②小(1分)
(2分) ②小(1分)
(2)1/12 (2分) bd (2分) (3)ac (2分) (4)< (2分) < (2分) <(2分)
【解析】
试题(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=c2(NH3)/c(N2)c3(H2)②该反应为热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小。
N2(g)+3H2(g)2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,2x/(1x+33x+2x)×100%=20% 解得x=1/3,平衡常数K=1/12; 由平衡的特征“等”、“定”可判定平衡,则a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;b.该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故b正确;c.υ正(N2)=2υ逆(NH3),正逆反应速率不等,反应没有达到平衡,故c错误; d.混合气体中 c(NH3)不变,为平衡的特征,达到平衡,故d正确;(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生氢气体积(V)的数据,根据数据绘制如图,则曲线a、b、c、d所对应的实验组别可能是( )

组别 | c(HCl)/(molL-1) | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.④—③—②—①B.①—②—③—④
C.③—④—②—①D.①—②—④—③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用bmol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________________。
(2)滴定操作时,左手控制滴定管,右手__________,眼睛要注视__________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由__________色变为__________色。
(4)水中溶解氧的计算式是__________(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果__________(填“偏高”“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
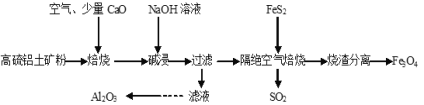
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,其原理图如图所示。铅蓄电池的工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+ 2H2O。下列判断错误的是( )
2PbSO4+ 2H2O。下列判断错误的是( )

A.铅蓄电池的结构中O2的作用可提高电池的工作效率
B.铅蓄电池放电时Pb电极的电极反应为:Pb-2e-=Pb2+
C.电池工作时,H+移向PbO2板
D.实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是0.075mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图,下列说法中不正确的是

A. 甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e-= 2H2O+O2↑
C. 甲池中随着反应的不断进行,溶液的pH减小
D. 若乙池中为一定量CuSO4溶液,通电一段时间后,向溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上。
(1)c(OH-)=1×10-3mol/L的溶液的pH=___________________
(2)0.01mol/L HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=_________________
(3)某溶液由水电离出H+的物质的量的浓度c(H+)= 1×10-5mol/L,则该溶液可以是______(填“硫酸”或“氯化铵”或 “氢氧化钠” 或“氯化钠”)溶液
(4)将0.39g过氧化钠溶于足量水中并配成100 mL溶液,则溶液的pH=_____________
(5)0. 12mol/L HCl溶液与0.1mol/L 的NaOH溶液等体积混合,混合液的pH=___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HCl→C6H5COOH+NaCl,有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | ﹣15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21 g | 0.34 g | 5.9 g |
实验流程如下:
(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因________。

(2)操作中有关分液漏斗的使用不正确的是___。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为_______。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 molL﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为___%(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com