
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:填空题
(14分)某溶液中可能含Mg2+、Al3+、Fe3+、Cu2+、NH4+、K+中的几种离子。当加入过量的过氧化钠时,有无色无味的气体产生,同时生成白色沉淀。加入的过氧化钠的量与产生沉淀的量之间的关系如图所示,试回答:
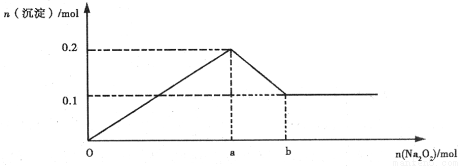
(1)该溶液中一定有 离子,一定没有 离子。
(2)无法确定是否含有 离子。要确定是否存在该离子,还需做 实验,存在该离子的实验现象为 。
(3)线段oa:ab=
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次考试化学试卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.金属在反应中只能作还原剂,非金属在反应中只能作氧化剂
B.氧化剂在反应中失去电子,还原剂在反应中得到电子
C.氧化剂具有氧化性,还原剂具有还原性
D.阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期月考化学试卷(解析版) 题型:选择题
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:填空题
(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) 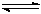 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。
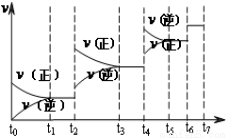
图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:填空题
(18分)已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为___ _____(填字母)。
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
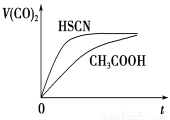
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L -1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
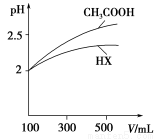
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),
c(CH3COO-)/c(CH3COOH)=________。
(7)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古巴彦淖尔市高一上学期期中考试化学试卷(解析版) 题型:选择题
在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是
A.Na+、SO32-、SO42-、K+
B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO4-、NO3-、Na+
D.K+、Ca2+、SO32-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com