
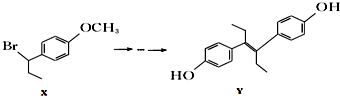
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
分析 A.化合物x中与Br相连的C连接4个不同基团;
B.化合物Y中含酚-OH和碳碳双键;
C.化合物Y中含酚-OH和碳碳双键;
D.氢氧化钠水溶液中加热,化合物X发生水解反应.
解答 解:A.化合物x中与Br相连的C连接4个不同基团,该碳原子为手性碳原子,故A错误;
B.化合物Y中含酚-OH和碳碳双键,则1mol化合物Y与浓溴水反应,最多消耗5mol Br2,故B正确;
C.化合物Y中含酚-OH可发生缩聚反应,含碳碳双键可发生加聚反应,故C正确;
D.氢氧化钠水溶液中加热,化合物X发生水解反应,在NaOH、醇溶液中加热发生消去反应,故D错误;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃、卤代烃的性质,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
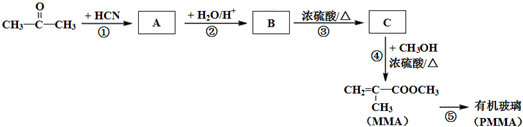
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$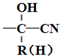
 .
. .
.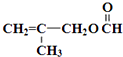
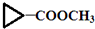
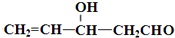
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
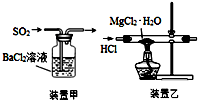
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
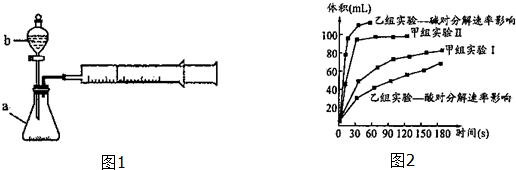
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com