
| m |
| M |
| V |
| Vm |
| N |
| NA |
| M |
| Vm |
| 18g |
| 18g/mol |
| 6.72L |
| 22.4L/mol |
| 3.01×1023 |
| 6.02×1023 |
| M |
| Vm |


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、1molNH4+所含的质子数为10NA |
| B、常温常压下,11.2L氧气含原子数为NA个 |
| C、常温常压下,16g O2和O3的混合气体所含原子数为NA |
| D、7.8g过氧化钠与足量CO2反应转移电子0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/s | 0 | 50 | 100 |
| c(N2O5)/mol?L-1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

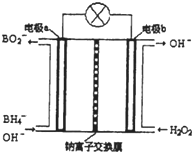
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的课题为“Mg-C原电池电解KI-淀粉溶液的研究”,他们的研究装置如右图.有关说法不正确的是( )
某研究性学习小组的课题为“Mg-C原电池电解KI-淀粉溶液的研究”,他们的研究装置如右图.有关说法不正确的是( )| A、镁为负极 |
| B、原电池中碳极的电极反应为:Fe3++e-═Fe2+ |
| C、电解池中阳极处先变红 |
| D、电解池中阴极的电极反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、HCO3-的电离程度大于HCO3-的水解程度 |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离只有:NaHCO3=Na++HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com