
分析 (1)硫铁矿和氧气反应生成氧化铁和二氧化硫气体,二氧化硫与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸;
(2)锌与浓硫酸反应生成硫酸锌、二氧化硫和水;锌与稀硫酸反应生成硫酸锌和氢气;
(3)亚硫酸钠与氧气反应生成硫酸钠;
(4)亚硫酸钠与硫酸反应生成硫酸钠和二氧化硫和水.
解答 解:(1)硫铁矿和氧气反应生成氧化铁和二氧化硫气体,化学方程式:4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2;二氧化硫与氧气反应生成三氧化硫,化学方程式:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;三氧化硫与水反应生成硫酸,化学方程式:SO3+H2O=H2SO4;
故答案为:4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2;2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;SO3+H2O=H2SO4;
(2)锌与浓硫酸反应生成硫酸锌、二氧化硫和水,化学方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;锌与稀硫酸反应生成硫酸锌和氢气,离子方程式:Zn+2H+=H2↑+Zn2+;
故答案为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;Zn+2H+=H2↑+Zn2+;
(3)亚硫酸钠与氧气反应生成硫酸钠,离子方程式:2SO32-+O2=2SO42-;
故答案为:2SO32-+O2=2SO42-;
(4)亚硫酸钠与硫酸反应生成硫酸钠和二氧化硫和水,离子方程式:SO32-+2H+=H2O+SO2↑;
故答案为:SO32-+2H+=H2O+SO2↑;
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质是解题关键,注意硫酸与锌反应时,浓度不同发生反应不同,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 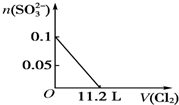 | B. | 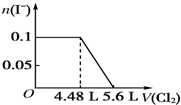 | ||
| C. | 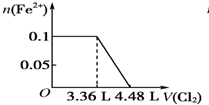 | D. | 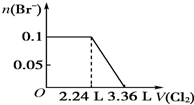 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{a}L$ | B. | $\frac{2m}{3a}L$ | C. | $\frac{m+n}{a}L$ | D. | $\frac{2(m+n)}{3a}L$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•3H2O | B. | CuSO4•2H2O | C. | CuSO4•H2O | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 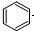 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$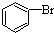 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com