
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是( )

A.WZ沸点高于W2Y的沸点
B.含Z的两种酸反应可制得Z的单质
C.W2Y2中既含离子键又含共价键
D.X的含氧酸一定为二元弱酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
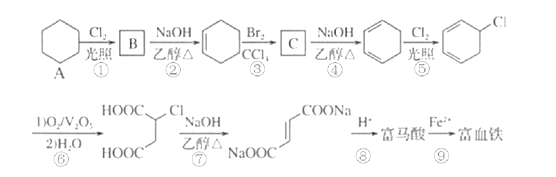
(1)A的化学名称为___;由A生成B的反应类型为__。
(2)C的结构简式为___。
(3)写出③和④的化学反应方程式:
反应③:___。
反应④:___。
(4)富马酸不能发生的反应___。
A.取代反应 B.加成反应 C.消去反应 D.氧化反应
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出___LCO2(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
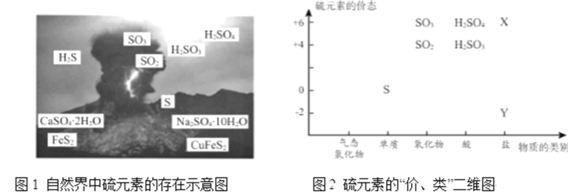
从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:
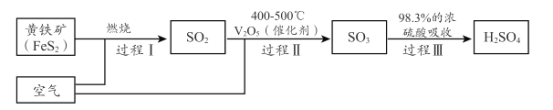
①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2 和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 100 |
c ( SO2 ) / ( mol L -1) | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 | 1 |
c ( O2 ) / ( mol L -1) | 5 | 3.5 | a | 1.75 | 1 | 0.5 | b | 0.5 | 0.5 |
c ( SO3 ) / ( mol L -1) | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 | 9 |
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2 和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题
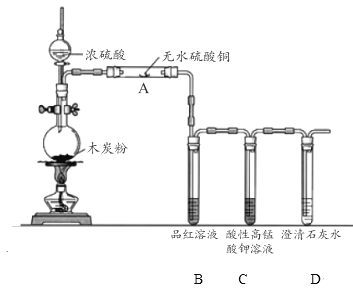
①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是( )
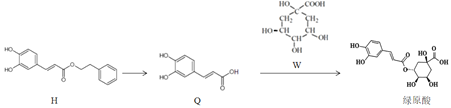
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.绿原酸可发生加成、氧化、还原和取代反应
D.W既属于羧酸类化合物又属于酚类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
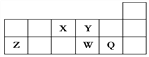
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
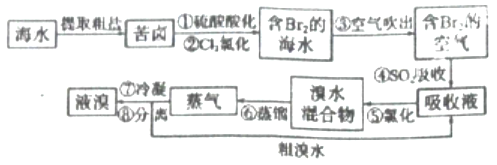
(1)步骤①中叫硫酸酸化可提高Cl2的利用率,理由是 。
(2)步骤④利用了SO2的还原性,反应的离子方程式为 。
(3)步骤⑥的蒸馏过程中,温度应控制在8090℃。温度过高或过低都不利于生产,请解释原因_______ 。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 。
(5)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中 Fe2+和 Fe3+的浓度恰好相等。则已反应的 Fe3+和未反应的 Fe3+的物质的量之比为:
A.4:3B.3:2C.2:3D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硅酸(H2SiF6)制备冰晶石(Na3AlF6)的工艺流程如图所示:
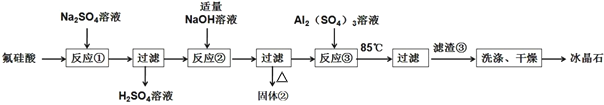
已知:冰晶石(Na3AlF6)微溶于水。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是_____。
(2)已知氟硅酸(H2SiF6)酸性强于硫酸,写出反应①的化学方程式______。
(3)反应②为脱硅工艺,固体②是_____。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为_____;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物_____。
(5)干燥前,检验冰晶石是否洗涤干净的实验方法是_____。
(6)从母液中可循环利用的物质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种元素X、Y、Z、Q、T。X原子最外层M层上有2个未成对电子且无空轨道;Y原子的价电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2O3
B.T的一种单质的空间构型为正四面体形,键角为![]()
C.X和Q结合生成的化合物为共价化合物
D.ZO2是极性键构成的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com