
【题目】一定条件下,下列厨房用品的主要成分或有效成分不能水解的是( )
A.小苏打B.食醋C.淀粉D.植物油
科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
![]()

【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

①鼓入空气的作用是_________________________________。
②反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
H2O2可以看作是一种很弱的酸,写出其电离方程式:_____________________。
(3)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4LH2O含有的分子数为NA
B. 常温常压下,NA个CO2分子占有的体积为22.4L
C. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将某溶液与稀盐酸反应产生的气体通入澄 清 石灰 水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
B | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加碘酸钾 |
C | 将乙烯通入溴的四氯化碳溶液 | 溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性比苯酚强 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利用如图装置

可以模拟铁的电化学防护,其中Y为NaCl。为减缓铁的腐蚀:
①若X为碳棒,开关K应置于 (填字母,下同)处。
②若X为锌,开关K应置于 处。
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有地铁、城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质均为NaCl溶液)。

你认为其中能合理模拟金属管道的腐蚀原理的是 ;图c中的总反应方程式是 ;
Ⅱ.1 L某溶液中含有的离子如下表:
离子 | Cu2+ | Al3+ |
| Cl- |
物质的量浓度/(mol·L-1) | 2 | 1 | 4 | x |
用惰性电极电解该溶液,当电路中有5 mol e-通过时,溶液的c(H+)= mol/L (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是
A. PM2.5是指微粒直径不大于2.5 um 的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入生石灰可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以化合物I为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行.化合物Ⅵ广泛用于香精的调香剂.
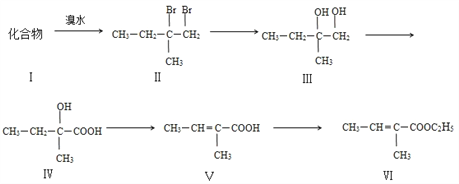
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为______________,该化合物核磁共振氢谱中有____________个吸收峰;
(2)化合物Ⅱ生成化合物Ⅲ发生______________反应,其方程式为____________________________(注明反应条件);
(3)化合物Ⅴ有多种同分异构体.请写出与化合物Ⅴ官能团种类相同且无支链的所有同分异构体的结构简式______________________________________________________________________;
(4)化合物Ⅵ不能发生的反应类型是______________(填字母).
A.加成反应 B.酯化反应 C.水解反应 D.加聚反应
(5)写出化合物Ⅵ在一定条件下反应,生成高分子化合物的化学方程式:______________________________________(不需注明条件).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硝通常指将烟气中的氮氧化物(NOx)转化为无害的物质。
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-905.5kJ mol-1
4NO(g)+6H2O(g) △H=-905.5kJ mol-1
N2(g)+O2(g)![]() 2NO(g) △H=+180kJ mol-1
2NO(g) △H=+180kJ mol-1
完成该方法中主要反应的热化学方程式:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
该方法应控制反应温度在315~400℃之间,反应温度不宜过低也不宜过高的原因是_________________。
②氨氮比[![]() ]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当
]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是__________________。
>1.0时,烟气中NO浓度反而增大,主要原因是__________________。

(2)直接电解吸收也是脱硝的一种方法,用6%的稀硝酸吸收NOx生成HNO2(—元弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右上图所示。
①图中b应连接电源的_____________(填“正极”或“负极”)。
②阳极的电极反应式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com