
| A | |
| | C |
 (1) (2)还原(1分) Cl2+SO2+2H2O=4H++2Cl-+SO42-(2分)
(1) (2)还原(1分) Cl2+SO2+2H2O=4H++2Cl-+SO42-(2分) 。
。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③⑧ | B.②③④⑥ | C.①④⑤⑦ | D.②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④ | B.①④ | C.③④ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
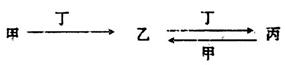
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.自然界中没有游离态的硅,纯净的硅晶体可用于制作光导纤维 |
| B.可用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| C.将SO2通人品红溶液,溶液褪色后加热能恢复原色 |
| D.从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤,氧化剂一般选择氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4 | B.5 | C.6 | D.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
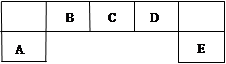
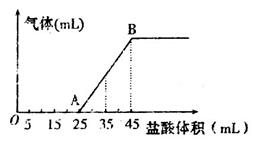
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com