
将ag Fe2O3、Al2O3样品溶解在过量的200 mL 0.05 mol/L的硫酸溶液中然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.4 mol·L-1 D.0.8 mol·L-1
科目:高中化学 来源: 题型:
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可 得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: B : C: D :
(2)写出A、B、E三种微粒反应的离子方程式:
、
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)==CO2(g);△H1 C(s)+ O2(g)==CO(g);△H2
O2(g)==CO(g);△H2
②S(s)+O2(g)==SO2(g);△H3 S(g)+O2(g)==SO2(g);△H4
③H2(g)+ O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B.1∶3 C.1∶4 D.2∶3
1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是
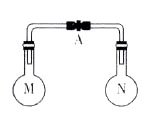
| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | H2 | N H2 | NO |
| 气体N | SO2 | Cl2 | HCl | O2 |
A.①②③④ B.②④①③ C.④①②③ D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤Ba2SO4固体 ⑥纯蔗糖(C12H22O11) ⑦酒精(C2 H5OH) ⑧熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是___________。
(2)以上物质中属于电解质的是__________。
(3)以上物质中属于非电解质的是__________。
(4)以上物质中溶于水后形成的水溶液能导电的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
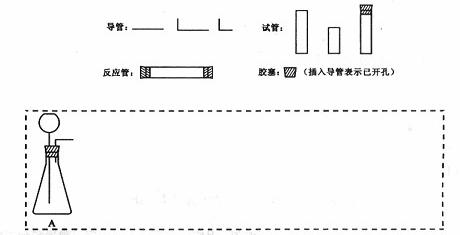
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和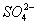 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
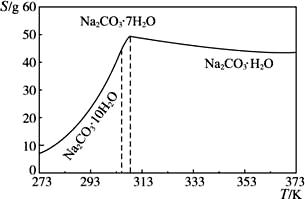
回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com