
| A. | 食盐加碘所添加的是碘酸钾 | |
| B. | 油脂既能为人体提供热量,又能提供人体必需脂肪酸 | |
| C. | 棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 | |
| D. | 蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
分析 A.食盐加碘所添加的是碘酸钾而不是碘单质;
B.油脂能水解生成高级脂肪酸和甘油;
C.羊毛的成分是蛋白质;
D.蛋白质遇铵盐溶液能产生盐析现象,盐析具有可逆性.
解答 解:A.碘单质易升华,食盐加碘所添加的是碘酸钾而不是碘单质,故A正确;
B.油脂水解会产生甘油和高级脂肪酸,同时也是产生能量最多的物质,既能为人体提供热量,又能提供人体必需脂肪酸,故B正确;
C.棉花的主要成分是纤维素,燃烧产生CO2和H2O;羊毛的主要成分是蛋白质,燃烧会产生二氧化碳和水、N2等,合成纤维中含有C、H,所以完全燃烧只生成二氧化碳和水,故C错误;
D.蛋白质遇饱和硫酸铵溶液由于溶质的溶解度减小而结晶析出,所以产生的沉淀能重新溶于水,故D正确;
故选C.
点评 本题考查有机物结构和性质、元素化合物等知识点,为高频考点,明确物质成分及物质性质是解本题关键,注意蛋白质变性与盐析的区别,易错选项是C.


科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
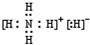 .
.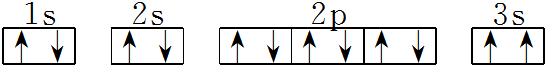 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
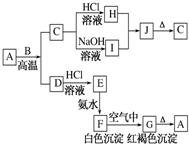 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
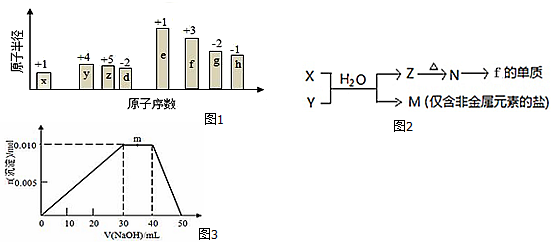
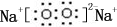 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金 | B. | 硅酸盐材料 | C. | 有机高分子材料 | D. | 无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com