(1)食品和药品关系人的生存和健康.
①市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是
A
A
(填字母).
A.加钙盐 B.加碘盐 C.加锌盐
②碳酸镁可治疗胃酸过多的原理是
MgCO3+2H+=Mg2++CO2↑+H2O
MgCO3+2H+=Mg2++CO2↑+H2O
(用离子方程表示).
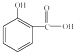
③阿司匹林具有
解热镇痛
解热镇痛
作用.长期大量服用阿司匹林,其水解产物水杨酸可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO
3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
.
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活.
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点
低
低
(选填“高”或“低”).
②炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.铁锅的腐蚀主要是由
电化学腐蚀
电化学腐蚀
(填“化学腐蚀”或“电化学腐蚀”)造成的,铁锅锈蚀的负极电极反应式为
Fe-2e-═Fe2+
Fe-2e-═Fe2+
.
③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有CaCO
3、
Na2CO3
Na2CO3
(填化学式)和SiO
2.
(3)防治环境污染,改善生态环境已成为全球的共识.
①pH<5.6的雨水称为酸雨,主要是由人为排放的硫氧化物和
氮氧化物
氮氧化物
等酸性气体转化而成的.向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO
2.发生反应的化学方程式为
2CaCO
3+O
2+2SO
22CaSO
4+2CO
22CaCO
3+O
2+2SO
22CaSO
4+2CO
2.
②城市餐饮业会产生大量污染环境的“地沟油”.综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和
高级脂肪酸
高级脂肪酸
.生活中会产生大量废弃塑料,将废弃塑料进行
裂解
裂解
处理,可以获得乙烯、丙烯等化工原料.
③含铬元素的废水必须治理达标.某兴趣小组探究含铬(Cr
2O
72ˉ)废水的处理方法,经查阅资料,拟采用(NH
4)
2Fe(SO
4)
2将Cr
2O
72ˉ还原为Cr
3+,再用氨水将Cr
3+转变成难溶的Cr(OH)
3.该方案运用了污水处理方法中的氧化还原法和
沉淀法
沉淀法
.指导老师指出该方案处理后的废水中因含有大量
NH4+
NH4+
(填离子符号),能导致水体富营养化.

 (1)食品和药品关系人的生存和健康.
(1)食品和药品关系人的生存和健康.

 和
和
 和
和
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.