
| A. | 常温下pH=5的盐酸溶液稀释103倍后,pH等于8 | |
| B. | 浓度均为0.1 mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 | |
| C. | Na2CO3溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的KOH溶液等体积混合,溶液呈中性 |
分析 A.酸无限稀释不能变成碱溶液或中性溶液,只能是接近中性溶液;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.常温下,pH=2的醋酸溶液浓度大于pH=12的KOH溶液,二者等体积混合,醋酸有剩余,溶液呈酸性.
解答 解:A.酸无限稀释不能变成碱溶液或中性溶液,只能是接近中性溶液,所以常温下pH=5的盐酸稀释100倍时溶液pH接近7,故A错误;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,一水合氨抑制水电离、氯化铵促进水电离,所以水电离出的c(H+)前者小于后者,故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D.常温下,pH=2的醋酸溶液浓度大于pH=12的KOH溶液,二者等体积混合,醋酸为弱酸,则混合液中醋酸有剩余,溶液呈酸性,故D错误;
故选B.
点评 本题考查离子浓度大小比较、溶液酸碱性判断及pH的计算,题目难度中等,明确溶液中的溶质及其性质是解本题关键,利用电荷守恒、物料守恒判断,易错选项是A,酸或碱无限稀释接近中性时要考虑水的电离.


科目:高中化学 来源: 题型:解答题
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
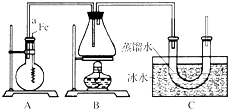 按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com