
(10分)某混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH |
可能大量含有的阴离子 | Clˉ、Brˉ、Iˉ、CO32ˉ、AlO |
为探究其成分,进行了以下探究实验。
(1)探究一:
溶液的体积(V)的关系如下图所示。

①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Clˉ、Brˉ、Iˉ,若向1 L该混合溶液中通入一定量的Cl2,溶液中Clˉ、Brˉ、Iˉ的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
n (Clˉ) | 2.5 mol | 3.5 mol | 4.0 mol |
n (Brˉ) | 3.0 mol | 2.5mol | 2.0 mol |
n (Iˉ) | x mol | 0 | 0 |
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为 ________________ ;
②原溶液中Clˉ、Brˉ、Iˉ的物质的量浓度之比为______________________。
(1)①Ag+、Mg2+、Fe3+(2分) CO32ˉ、AlO2- (2分) ②Al(OH)3+OH-=AlO2-+2H2O(2分)
(2) 4Cl2+6 Iˉ+2Brˉ=3I2+8Clˉ+Br2(2分); 1:2:1 (2分)
【解析】
试题分析:(1)向该溶液中加入NaOH溶液,开始无沉淀产生,证明含有H+,首先发生酸碱中和反应,由于H+与CO32ˉ、AlO2-会发生离子反应而不能大量共存,所以不含CO32ˉ、AlO2-;后来当H+反应完全时产生沉淀,而且当沉淀达到最大值后,加入NaOH溶液,沉淀的质量不变,所以含有NH4+,此时发生反应:NH4++OH-=NH3·H2O;后来沉淀又逐渐溶解至完全消失,说明含有Al3+,沉淀溶解就是Al(OH)3与过量的NaOH的反应,而无Ag+、Mg2+、Fe3+;综上所述①该溶液中一定不存在的阳离子是Ag+、Mg2+、Fe3+;一定不存在的阴离子是CO32ˉ、AlO2-;②沉淀减少过程中发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;(2)还原性:Clˉ<Brˉ<Iˉ; 若向1 L该混合溶液中通入一定量的Cl2,首先发生反应:Cl2+2I-===2Cl-+I2 ;然后发生反应:Cl2+2Br-===2Cl-+Br2。当通入Cl2的体积为11.2 L时,溶液中I-还有剩余,说明氯气只与I-反应:Cl2+2I-==I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol=1.5mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,发生反应的Br-的物质的量是:3.0 mol-2.5 mol=0.5mol;根据方程式Cl2+2Br-==Br2+2Cl-,可知0.5mol的Br-反应消耗Cl2 0.25 mol,所以Cl2+2I-==I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol=0.75 mol,因此原溶液中的I-为:0.75 mol×2=1.5 mol.故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I-==8Cl-+Br2+3I2。
考点:考查离子的共存、离子反应的先后顺序及离子的物质的量多少的计算的知识。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2014-2015学年河北省保定市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干
B.蒸馏操作时,应使温度计水银球插入液态混合物中
C.分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
D.萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇高一上学期期中化学(理)试卷(解析版) 题型:选择题
下列物质分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液的方法分离四氯化碳和水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:选择题
某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:选择题
用标准浓度的NaOH溶液来滴定未知浓度的盐酸,在下列操作中,会使盐酸测定浓度偏大的是
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱试滴定管读数时,视线高于刻度线
A.②③ B.①③ C.①④ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(本小题共4分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)离子方程式是重要的化学用语。下列是有关离子反应的一些错误观点,请在下列表格中用相应的一个“离子方程式”否定这些观点。(不能相同)
①强酸与强碱发生中和反应均可表示为:H++OH-=H2O |
|
②强酸与碱混合一定发生中和反应 |
|
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.NaAlO2溶液中通入过量的CO2:2AlO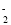 +3H2O+CO2===2Al(OH)3↓+CO
+3H2O+CO2===2Al(OH)3↓+CO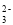
B.明矾溶液中滴加Ba(OH)2溶液至SO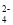 完全沉淀:Al3++Ba2++SO
完全沉淀:Al3++Ba2++SO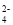 +3OH-===BaSO4↓+Al(OH)3↓
+3OH-===BaSO4↓+Al(OH)3↓
C.200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:
4Fe2++6Br-+5Cl2===4Fe3++3Br2+10Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeO +3Cl-+H2O+4H+
+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高二上学期期中化学试卷(选修)(解析版) 题型:选择题
关于下列物质用途的说法错误的是
A.聚氯乙烯塑料制品可用于包装食品
B.乙二醇可用于配制汽车防冻液
C.部分卤代烃可用作灭火剂
D.三硝基甲苯是一种黄色烈性炸药,常用于国防和民用爆破
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com