
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
分析 A.氧化性:Fe3+>I2,则碘离子先被氧化;
B.溴和亚铁离子发生氧化还原反应;
C.酸性HClO>HCO3-,则二氧化碳和次氯酸钠反应生成碳酸氢钠和次氯酸;
D.能使pH试纸显深红色的溶液中,说明溶液呈强酸性,弱酸根离子、还原性离子不存在.
解答 解;A.氧化性:Fe3+>I2,则碘离子先被氧化,离子方程式为2I-+Cl2═I2+2Cl-,则转移的电子数小于0.3NA,故A错误;
B.氧化性:Br2>Fe3+,向溴水中加入足量氯化亚铁溶液溴单质能将亚铁离子氧化为浅黄色的三价铁离子,故B错误;
C.酸性HClO>HCO3-,则二氧化碳和次氯酸钠反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O=HClO+HCO3-,故C错误;
D.能使pH试纸显深红色的溶液中,说明溶液呈强酸性,弱酸根离子、还原性离子不存在,这几种离子之间不反应,所以能共存,故D正确.
故选D.
点评 本题以氧化还原反应为载体考查了离子方程式的书写,明确酸性强弱、离子反应先后顺序是解本题关键,根据物质之间的反应来分析解答,题目难度不大,易错选项是A.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 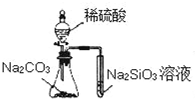 实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 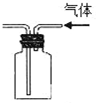 实验装置排空气法收集CO2气体 | |
| C. | 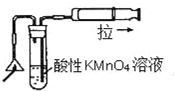 可以检验火柴燃烧生成的SO2气体 | |
| D. | 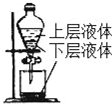 提取海带中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
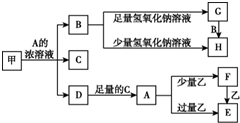 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
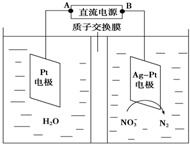 目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3-或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3-或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )| A. | 若以铅蓄电池做电源进行电解,Pt电极为阴极 | |
| B. | 电解过程中H+向正极移动 | |
| C. | 若电解过程中转移1mol电子,则交换膜两侧电解液的质量变化差为7.2g | |
| D. | 理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
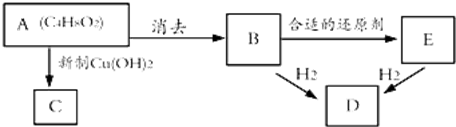
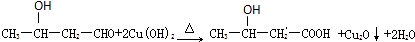 .
.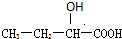 、
、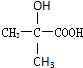 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
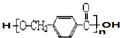 其合成路线如下:
其合成路线如下: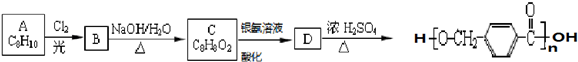
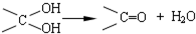
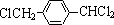 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.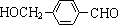 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$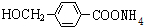 +2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n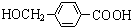 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$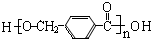 +(n-1)H2O.
+(n-1)H2O.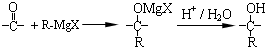
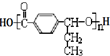 ,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com