
下列对化学概念判断的依据正确的是( )
A.溶液与胶体:不同的本质原因是否发生丁达尔效应
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
在元素周期表中,金属元素和非金属元素分界线附近能找到:
A.制半导体元素
B.制农药元素
C.制催化剂元素
D.制耐高温合金的元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:选择题
pH=2的盐酸和pH=12的氨水等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) B.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-)  D.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德市高二12月月考化学卷(解析版) 题型:实验题
市售乙醛通常为40%左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液。据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:
(C2H4O)n  nC2H4O。
nC2H4O。
(1)先把混合物分离得到(C2H4O)n:将混合物放入____中,静置,分离操作名称为______。
(2)证明是否已有部分乙醛被氧化的实验操作和现象是______________。
(3)提取乙醛的装置如图:烧瓶中放的是(C2H4O)n和6mol/LH2SO4的混合液,锥形瓶中是蒸馏水。加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中。

①用冷凝管的目的是________,冷凝水的进口是_____(填“a”或“b”)。
②锥形瓶内导管口出现气泡,从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛具有___的性质,当观察到导气管中气流很小时,必要的操作是_____,目的是__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷(解析版) 题型:填空题
(1)实验室制取Cl2的反应方程式之一为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O被氧化的盐酸占反应盐酸总量的 ,当标准状况下有11.2L氯气生成时,该反应的电子转移数为 。
(2)用双线桥法标出电子转移情况:3BrF3+5H2O=HBrO3+Br2+O2+9HF,当180g水都做还原剂时,被自身还原的BrF3 是 mol。
(3)已知下列两个氧化还原反应:O2+4HI=2I2+2H2O 及Na2S+I2=2NaI+S,则三种单质的氧化性由强到弱的顺序为:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高二上期中化学卷(解析版) 题型:选择题
在由水电离出的c(H+)=1×10-13 mol·L-1的溶液中一定大量共存的离子组是
A.Fe2+、Na+、NO3-、 Cl-
B. Ba2+、Na+、NO3-、Cl-
C.SO42-、S2O32-、NH4+、Na+
D.Mg2+、Na+、Br -、AlO2-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高二上学期期中考试化学试卷(解析版) 题型:填空题
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO 浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K =______。
(2)前2s 内的平均反应速率v(CO2)=________。
(3)在上述条件下反应能够自发进行,则反应的△H___0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是____
A.反应混合物各组分物质的量浓度相等
B. NO 、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗lmolNO的同时,就有lmolCO生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东枣庄三中高二10月学情调查化学卷(解析版) 题型:填空题
氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:
(1)依据反应: 设计的原电池如图所示。
设计的原电池如图所示。
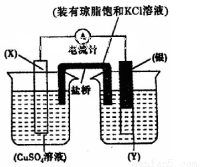
则电解质溶液Y是________________ (填化学式),X的电极反应式___________________,盐桥中的Cl-移向_______________溶液(填化学式)。若将盐桥换成铜丝,则X电极名称是____________。
(2) 利用下图的装置可以模拟铁的电化学防护:
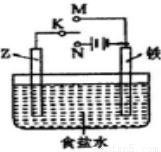
若Z为碳棒,为延缓铁腐蚀,K应置于____处,总反应的离子方程式为__________________ ;若Z为锌,开关K置于M处,该电化学防护法称为____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东湛江第一中学高一上第二次考试化学卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol锌粒与足量盐酸反应产生11.2 L H2
B.标准状况下,11.2 L H2O所含分子数为0.5NA
C.0.5 mol•L﹣1的MgCl2溶液中含有Cl﹣个数为NA
D.25℃、101Pa时,16g O2和O3混合气体中含有的原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com