
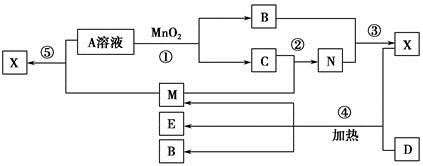
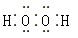
 Fe ②2Fe3++SO2+2H2O=2Fe2++
Fe ②2Fe3++SO2+2H2O=2Fe2++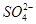 +4H+ (2)448 (3)C+2H2SO4(浓)
+4H+ (2)448 (3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O 。②SO2具有还原性,Fe3+具有较强的氧化性,SO2在水溶液中可被Fe3+氧化成硫酸。(2)若D为红色单质,则D为Cu,Cu与浓硫酸反应得到的E为CuSO4,用惰性电极电解硫酸铜溶液过程中,阳极生成O2,导线中通过0.08 mol电子时,阳极共生成0.02 mol O2,其体积在标准状况下为448 mL。原溶液中n(CuSO4)=0.1 L×0.05 mol·L-1=0.005 mol,若Cu2+完全反应,转移电子0.005 mol×2=0.01 mol,而实际转移电子为0.08 mol,则说明还存在水的电解,故硫酸铜经电解后完全转化为H2SO4,则c(H+)=2c(CuSO4)=2×0.05 mol·L-1=0.1 mol·L-1,故pH=1。(3)短周期元素中能形成黑色固体单质的是碳,碳与浓硫酸在加热条件下可反应生成CO2、SO2和水。(4)SO2、CO2均是酸性氧化物,与碱反应的现象相似;但SO2具有漂白性和还原性,故可用品红溶液检验SO2,然后用酸性高锰酸钾溶液除去SO2,再用品红溶液检验SO2是否除尽,最后用澄清石灰水检验CO2。由于检验SO2和CO2的试剂均是水溶液,故需首先用无水CuSO4检验产物中的水蒸气,合理的选项为C。
。②SO2具有还原性,Fe3+具有较强的氧化性,SO2在水溶液中可被Fe3+氧化成硫酸。(2)若D为红色单质,则D为Cu,Cu与浓硫酸反应得到的E为CuSO4,用惰性电极电解硫酸铜溶液过程中,阳极生成O2,导线中通过0.08 mol电子时,阳极共生成0.02 mol O2,其体积在标准状况下为448 mL。原溶液中n(CuSO4)=0.1 L×0.05 mol·L-1=0.005 mol,若Cu2+完全反应,转移电子0.005 mol×2=0.01 mol,而实际转移电子为0.08 mol,则说明还存在水的电解,故硫酸铜经电解后完全转化为H2SO4,则c(H+)=2c(CuSO4)=2×0.05 mol·L-1=0.1 mol·L-1,故pH=1。(3)短周期元素中能形成黑色固体单质的是碳,碳与浓硫酸在加热条件下可反应生成CO2、SO2和水。(4)SO2、CO2均是酸性氧化物,与碱反应的现象相似;但SO2具有漂白性和还原性,故可用品红溶液检验SO2,然后用酸性高锰酸钾溶液除去SO2,再用品红溶液检验SO2是否除尽,最后用澄清石灰水检验CO2。由于检验SO2和CO2的试剂均是水溶液,故需首先用无水CuSO4检验产物中的水蒸气,合理的选项为C。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:不详 题型:填空题
| 族 周期 | IA | IIA | IIIA | VIA | VA | VIA | VIIA | 0 |
| 2 | | | | ⑥ | | ⑦ | | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第15列元素的最高价氧化物为R2O5 |
| B.第三周期元素的离子半径,从左到右逐渐减小 |
| C.同周期第ⅡA族与第IIIA族的元素原子序数之差可能为1或11或25 |
| D.只含有非金属元素的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
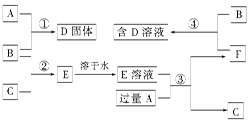
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
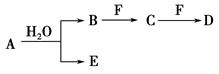
 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:HClO4>H3PO4>H2SO4 | B.氢化物稳定性:H2S>HF>H2O |
| C.碱性:NaOH>Mg(OH)2>Ca(OH)2 | D.氧化性:F2 > Cl2 > Br2 > I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com