
【题目】向稀氨水中加入下列物质,能使溶液中的铵根离子浓度减小、pH增大的是
A.水 B.氨气 C.氢氧化钠固体 D.氯化铵固体
科目:高中化学 来源: 题型:
【题目】化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
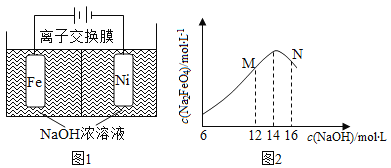
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.23gNO2和23gN2O4所含原子数目均为1.5NA
B.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
C.在常温常压下11.2L氯气所含的原子数目为NA
D.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe +2H2O=Fe(OH)2+Ni(OH)2
(1)金属镍在元素周期表中的位置是______________。
(2)此蓄电池放电时,该电池发生氧化反应的物质是________(城序号)。
A. NiO2 B.Fe C. Fe(OH)2 D.Ni(OH)2
(3)此蓄留电池充电时,阳极的电极反应式是____________。
(4)用该蓄电池电解含有0.2molNaCl的混合溶液100mL,假如电路中转移了0.1mo电子,且电解池的电极均为惰性电极。阳极产生的气体在标准状况下的体积是________;将电解后的溶液加水稀释至1L,此时溶液的pH=________________。
(5)该电池电极材料对环境有危害。在对电池进行回收处理过程中遇到以下问题:己知:常温下Ksp[Fe(OH)3]=1.0×10-34,Ksp[Ni(OH)2]=1.0×10-15。某溶液中含有0.1mol/L的Ni2+和0.1mol/LFe3+,当逐滴加入NaOH溶液(忽略溶液体积改变),
①先沉淀的离子是________。
②要想使Fe3+沉淀完全,Ni2+不沉淀,溶液的pH需控制的范围是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是( )

A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
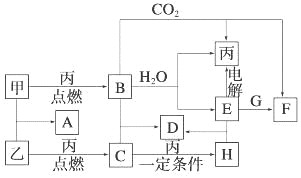
请回答下列问题:
(1)用化学式表示:丙为 ,H为 。
(2)A的电子式为 。
(3)写出B+C→D的化学方程式 。
写出E+G→F的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com