
| A. | O3 | B. | PCl3 | C. | Na2O2 | D. | NH4Cl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物,据此分析.
解答 解:A.O3是只有一种元素构成的纯净物,是单质,不是化合物,故A错误;
B.PCl3中只含共价键,为共价化合物,故B正确;
C.Na2O2中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,为离子化合物,故C错误;
D.NH4Cl中铵根离子和氯离子之间存在离子键,氢原子和氮原子之间存在共价键,为离子化合物,故D错误;
故选B.
点评 本题考查了化学键和化合物的关系,明确离子化合物和共价键化合物的概念是解本题关键,注意:并不是所有的物质中都含有化学键,稀有气体中不含化学键,为易错点.


科目:高中化学 来源: 题型:选择题
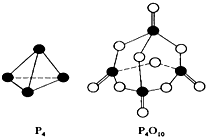 白磷在氧气中燃烧的反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧的反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )| A. | 6a+5d<4c+10b | B. | △H=(4c+12b-6a-5d) kJ•mol-1 | ||
| C. | 6a+5d>4c+12b | D. | △H=(6a+5d-4c-12b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→Na2SiO3 | B. | CuO→Cu (OH)2 | C. | SO2→H2SO3 | D. | CaO→Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、I-、NO3-、CO32- | B. | NH4+、Fe3+、OH-、Br- | ||
| C. | K+、Cl-、Cu2+、NO3- | D. | Al3+、SO42-、Na+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.
海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
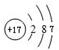 ;元素③的最低价氢化物的电子式为
;元素③的最低价氢化物的电子式为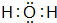 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com