
| A. | v(A)=2mol/(L•min) v(B)=2mol/(L•min) | |
| B. | v(A)=2mol/(L•min) v(C)=2mol/(L•min) | |
| C. | v(A)=1mol/(L•min) v(B)=2mol/(L•min) | |
| D. | v(A)=1mol/(L•min) v(C)=1.5mol/(L•min) |
分析 化学反应到达平衡时,同一物质的正逆反应速率相等,据此分析判断.
解答 解:化学反应到达平衡时,同一物质的正逆反应速率相等.
A、同一反应中,各物质的反应速率之比等于计量数之比,B物质的逆反应速率是2 mol/(L.min),A的逆反应速率为4mol/(L.min),A的正反应速率为2mol/(L.min),所以A的正逆反应速率不等,故A错误;
B、同一反应中,各物质的反应速率之比等于计量数之比,C物质的逆反应速率是2mol/(L.min),A的逆反应速率为$\frac{4}{3}$mol/(L.min),A的正反应速率为2mol/(L.min),所以A的正逆反应速率不等,故B错误;
C、同一反应中,各物质的反应速率之比等于计量数之比,B物质的逆反应速率是2 mol/(L.min),A的逆反应速率为4mol/(L.min),A的正反应速率为1mol/(L.min),所以A的正逆反应速率不等,故C错误;
D、同一反应中,各物质的反应速率之比等于计量数之比,C物质的逆反应速率是1.5 mol/(L.min),A的逆反应速率为1mol/(L.min),A的正反应速率为1mol/(L.min),所以A的正逆反应速率相等,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意:正逆反应速率相等是指同一物质的正逆反应速率相等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(HCl):用饱和NaHCO3溶液 | B. | CO2(SO2):用饱和KMnO4溶液 | ||
| C. | Cl2(HCl):用饱和NaCl溶液 | D. | SO2(HCl):用饱和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| B. | 氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 | |
| C. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| D. | 用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
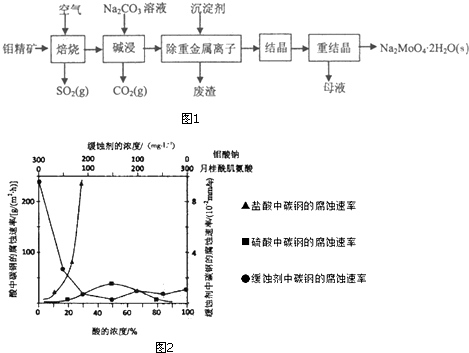
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
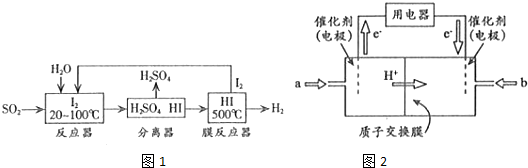
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 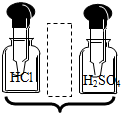 | B. |  | C. | 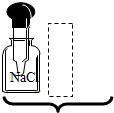 | D. | 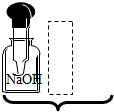 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.50mol/L | D. | 0.20mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com