

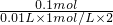 =5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3,故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;
=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3,故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;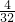 :
: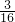 =2:3,则X为S2O32-,含S2O32-的溶液与氯气反应,有淡黄色沉淀生成,该淡黄色沉淀为S,上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解,说明生成SO42-,根据氧化还原反应,氯气被还原为氯离子,反应离子方程式为:H2O+S2O32-+Cl2=S↓+SO42-+Cl-+H+,故答案为:H2O+S2O32-+Cl2=S↓+SO42-+Cl-+H+;
=2:3,则X为S2O32-,含S2O32-的溶液与氯气反应,有淡黄色沉淀生成,该淡黄色沉淀为S,上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解,说明生成SO42-,根据氧化还原反应,氯气被还原为氯离子,反应离子方程式为:H2O+S2O32-+Cl2=S↓+SO42-+Cl-+H+,故答案为:H2O+S2O32-+Cl2=S↓+SO42-+Cl-+H+;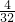 :
: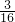 =2:3,则X为S2O32-,含S2O32-的溶液与氯气反应,有淡黄色沉淀生成,该淡黄色沉淀为S,上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解,说明生成SO42-,根据氧化还原反应,氯气被还原为氯离子,据此书写;
=2:3,则X为S2O32-,含S2O32-的溶液与氯气反应,有淡黄色沉淀生成,该淡黄色沉淀为S,上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解,说明生成SO42-,根据氧化还原反应,氯气被还原为氯离子,据此书写;

 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解
 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
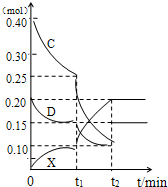
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
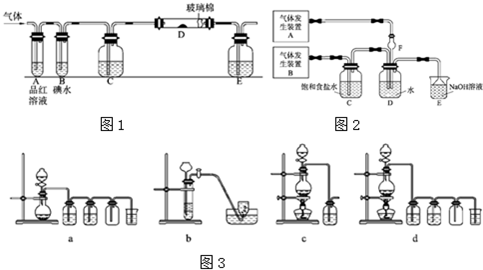
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com