

| A.砷化镓晶胞结构与NaCl相同 |
| B.砷化镓晶体中与同一个镓原子相连的砷原子构成正四面体 |
| C.电负性:As>Ga |
| D.砷化镓晶体中含有配位键 |


科目:高中化学 来源:不详 题型:填空题
 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.离子键 | B.共价键 | C.金属键 | D.配位键 E.氢键 F. 键 键 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
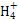 立体构型是 ,其中心原子的杂化方式为 。
立体构型是 ,其中心原子的杂化方式为 。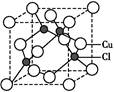
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4NaCl+O2;2CaO+2Cl2
4NaCl+O2;2CaO+2Cl2 2CaCl2+O2;SiO2+2CCl4
2CaCl2+O2;SiO2+2CCl4 SiCl4+2COCl2;Cr2O3+3CCl4
SiCl4+2COCl2;Cr2O3+3CCl4 2CrCl3+3COCl2。
2CrCl3+3COCl2。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com