
| A. | H2S?2H++S2- | B. | CH3COOH?H++CH3COO- | ||
| C. | NH3+H2O═NH${\;}_{4}^{+}$+OH- | D. | NaHCO3═Na++H++CO32- |
分析 A.硫化氢为多元弱酸,是弱电解质,部分电离,分步电离,以第一步为主;
B.醋酸为弱酸,是弱电解质,部分电离;
C.一水合氨为弱电解质,部分电离产生氨根离子与氢氧根离子;
D.碳酸氢根离子为弱酸的酸式根离子,不能拆.
解答 解:A.硫化氢属于弱电解质,部分电离,分步电离,以第一步为主,电离方程式:H2S?H++HS-,故A错误;
B.醋酸为弱酸,是弱电解质,部分电离,电离方程式:CH3COOH?H++CH3COO-,故B正确;
C.一水合氨为弱电解质,部分电离产生氨根离子与氢氧根离子,离子方程式:NH3+H2O?NH3•H2O?NH4++OH-,故C错误;
D.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方式是解题关键,注意多元弱酸分步电离,以第一步为主.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
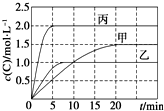 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | AxBy | |
| 甲 | 8g | 4g | 11g |
| 乙 | 7g | 5g | 11g |
| A. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO | B. | Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS | ||
| C. | 3Fe+2O2$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4 | D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 稀硫酸滴入含酚酞的Ba(OH)2溶液中 | 白色沉淀生成,溶液由红色变无色 | Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
| B | 磁性氧化铁(Fe3O4)溶于氢碘酸 | 磁性氧化铁溶解,溶液变棕黄色 | Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C | Ca(OH)2澄清溶液加到氯水中 | 溶液由黄绿色变为无色 | Cl2+2Ca(OH)2═Cl-+ClO-+Ca2++H2O |
| D | 稀硫酸加到KI淀粉溶液中 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com