下列叙述中正确的是( )
A.将pH=3的一元弱酸HA和pH=11的NaOH溶液混合后溶液显碱性,一定有:c(H+)<c(OH-)<c(A-)<c(Na+)
B.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2C03溶液、NaOH溶液:c(CH3COONa)>c(C6H5ONa)>c(Na2CO3)>c(NaOH)
C.在常温下,10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,体积为20mL,则溶液的pH=12+lg2
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(AI3+)<c(H+)<c(Na+)<c(CI-)
【答案】
分析:A、根据溶液显碱性的可能情况来判断;
B、根据水解过滤:越弱越水解来回答;
C、根据酸和碱混合后溶液的pH计算方法来回答;
D、根据0.2mol/L的盐酸与0.1mol/L的NaAlO
2溶液等体积混合反应后,所得溶液的组成情况来回答.
解答:解:A、将pH=3的一元弱酸HA和pH=11的NaOH溶液混合后溶液显碱性,可能是氢氧化钠剩余导致,还可能是生成的NaA中弱离子的水解导致,当碱大量剩余时,c(H
+)<c(A
-)<c(OH
-)<c(Na
+),故A错误;
B、根据离子的水解程度:CO
32->C
6H
5O
->CH
3COO
-,所以碱性是NaOH>CH
3COONa>C
6H
5ONa>Na
2CO
3,倒过来理解,当pH相同的CH
3COONa溶液、C
6H
5ONa溶液、Na
2C0
3溶液、NaOH溶液,浓度关系是:c(CH
3COONa)>c(C
6H
5ONa)>c(Na
2CO
3)>c(NaOH),故B正确;
C、10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)
2溶液充分混合,体积为20mL,则氢氧化钡剩余,
c(OH
-)=
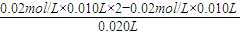
=0.01mol/L,所以pH=12,故C错误;
D、将0.2mol/L的盐酸与0.1mol/L的NaAlO
2溶液等体积混合发生反应,因1:1<n(H
+):n(AlO
2-)=2:1<4:1,故Al(OH)
3沉淀只有部分溶解为Al
3+,且Al
3+水解使溶液呈酸性,所以c(OH-)<c(H
+)<c(Al
3+)<c(Na
+)<c(Cl
-),故D错误.
故选B.
点评:本题是一道弱电解质的电离和盐的水解知识的综合题目,考查学生分析和解决问题的能力,综合性强,难度大.

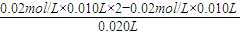 =0.01mol/L,所以pH=12,故C错误;
=0.01mol/L,所以pH=12,故C错误;

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案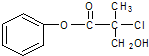 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )