
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s
浓度mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol·L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)达到平衡时N2O4的转化率为 %,表中c2 c3,a b (选填“>”“<”“=”)。
(2)20s的四氧化二氮的浓度c1= mol·L-1,在0s~20s内四氧化二氮的平均反应速率为 mol·(L·s)-1;。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |


查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.40molNO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
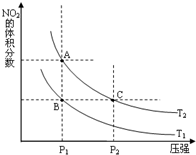 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com