
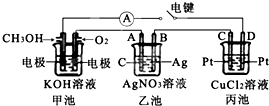
 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
| ||
| ||
| 5.4g |
| 108g/mol |
| 0.05 |
| 4 |
| 0.05 |
| 2 |


科目:高中化学 来源: 题型:
| A、此时醋酸和氢氧化钠溶液恰好中和 | ||
| B、溶液中存在未电离的醋酸分子 | ||
C、用含a的代数式表示醋酸(HAc)的电离常数为Ka=
| ||
| D、a肯定大于0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入NaOH溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g)平衡体系,增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 |
| D、工业合成氨工艺中,采用较高的压强来提高原料的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
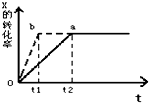 图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )
图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )| A、增大Y的浓度 |
| B、加入催化剂 |
| C、降低温度 |
| D、增大体系压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KNO3溶液 |
| B、K2CO3 溶液 |
| C、CuSO4 固体 |
| D、CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸根离子中不可能含有金属元素 |
| B、铁比铝容易生锈,是因为铁比铝活泼 |
| C、向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ |
| D、铝箔在酒精灯火焰山加热熔化但不滴落,因为铝箔表面的氧化铝熔点高于铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3的水解:SO3 2-+2H2O?H2SO3+2OH- |
| B、NaHCO3的电离:NaHCO3?Na++H++CO3 2- |
| C、KHS的电离:KHS=K++HS- |
| D、NaClO溶液与FeCl2溶液混合:2ClO-+Fe2++2H2O=2HClO+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、32He和42He是同一种核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com