
| A. | NaCN中碳元素的化合价为+4,是含碳的化合物,因此属于有机物 | |
| B. | 硝酸铵本身既具有氧化性又具有还原性,受热或撞击易发生爆炸 | |
| C. | 爆炸发生引发大火,可以用大量水灭火 | |
| D. | 为防止中毒,可用H2O2将NaCN还原为无毒物质 |
分析 A.依据化合物中元素化合价代数和为0计算,钠元素化合价+1价,氧元素化合价-2价;有机物一定含碳元素,但含碳的化合物不一定属于有机物;
B.硝酸铵转化N元素的化合价分别为-3、+5价;
C.Na与水反应生成氢气,氢气可燃烧;
D.氰化钠、过氧化氢发生氧化还原反应生成碳酸氢钠、水和氨气,氧化为无毒物质.
解答 解:A.NaCN中钠元素化合价+1价,氮元素化合价-3价,则化合价代数和为0计算,+1+x-3=0,x=+2,NaCN虽然含有碳元素,但是NaCN的性质和无机物相似,把它们归入无机物,故A错误;
B.硝酸铵转化N元素的化合价分别为-3、+5价,则硝酸铵本身具有氧化还原性,受热或撞击分解生成气体而易发生爆炸,故B正确;
C.Na与水反应生成氢气,氢气可燃烧,则爆炸发生引发大火,不能用大量水灭火,故C错误;
D.氰化钠、过氧化氢发生氧化还原反应,发生的离子反应为2CN-+5H2O2═2HCO3-+N2↑+4H2O,H2O2将NaCN氧化为无毒物质,故D错误;
故选B.
点评 本题考查物质性质的分析判断,侧重考查氧化还原反应,为高频考点,把握物质的性质、氧化还原反应原理熟练应用为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D |
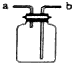 | 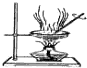 | 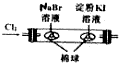 | 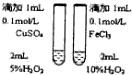 |
| 用该装置排空气法收集H2、CO2、Cl2等气体 | 蒸干AlCl3饱和溶液制备AlCl3晶体 | 可以证明氧化性Cl2>Br2>I2 | 比较不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
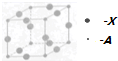 A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.
A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
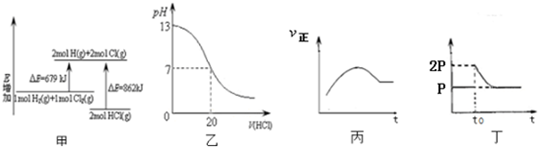
| A. | 图甲表示H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | 图乙表示室温时用0.1 mol/L盐酸滴定20 mL 0.1 mol/LNaOH溶液,溶液pH变化 | |
| C. | 图丙表示向恒容绝热的密闭容器中通入A和B,发生2A (g)+B (g)?2C(g)反应,其正反应速率随时间变化的示意图,则该反应为吸热反应 | |
| D. | 图丁表示在恒温密闭容器中,2BaO2(s)?2BaO(s)+O2(g)达到平衡,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡过程体系压强的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
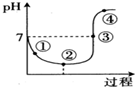 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为7、中子数为7的氮原子:${\;}_7^{14}$N | |
| B. | 氮原子的结构示意图: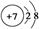 | |
| C. | 氨气分子的电子式: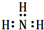 | |
| D. | 对硝基甲苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A. | O2在石墨Ⅱ附近发生氧化反应放电时,NO3-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ极附近发生的反应:NO+O2+e-=NO3 | |
| C. | 电池的总反应式为:4NO2+O2=2N2O5 | |
| D. | 当外电路通过4mole-,负极上共产生2molN2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com